Cấu tạo vỏ nguyên tử là gì và ra sao? Trong nguyên tử, electron chuyển động như thế nào? Thế nào là lớp, phân lớp electron? Mỗi lớp, phân lớp có tối đa bao nhiêu electron? Tất cả những câu hỏi này sẽ được giải đáp cụ thể trong bài viết sau đây.
LÝ THUYẾT CẤU TẠO VỎ NGUYÊN TỬ
I – Cấu tạo vỏ nguyên tử là gì?
Cấu tạo vỏ nguyên bao gồm các electron chuyển động rất nhanh (tốc độ hàng nghìn km/s) trong khu vực quanh hạt nhân nguyên tử không theo những quỹ đạo xác định.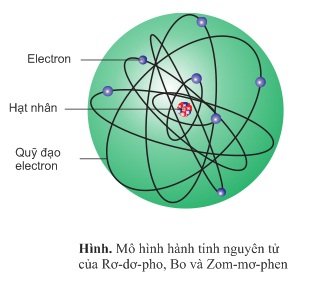
Số electron ở vỏ nguyên tử của một nguyên tố đúng bằng số proton trong hạt nhân nguyên tử và cũng bằng số hiệu nguyên tử (Z). Ví dụ như:
- Vỏ nguyên tử Hiđro (Z=1) có 1 electron
- Vỏ nguyên tử Oxi (Z=8) có 8 electron
- Vỏ nguyên tử Cacbon (Z=6) có 6 electron
Tuy rằng quỹ đạo của electron không xác định, nhưng các nghiên cứu cho thấy electron phân bố những quy luật nhất định. Vậy các electron phân bố như thế nào? Mời các bạn đọc tiếp phần II và III.
II – Lớp và phân lớp clectron
1. Lớp electron
Các electron nguyên tử được xếp thành từng lớp theo quy tắc:
- Electron có mức năng lượng từ thấp đến cao sẽ được xếp ở những lớp từ gần đến xa hạt nhân nguyên tử
- Những electron có mức năng lượng gần bằng nhau được xếp trên cùng một lớp
Các lớp electron được đánh số thứ tự và gọi tên theo chữ cái như sau:
| Lớp thứ n | 1 | 2 | 3 | 4 | … |
| Tên lớp | K | L | M | N | … |
2. Phân lớp electron
Mỗi lớp electron được chia thành các phân lớp. Hay nói cách khác là có nhiều phân lớp trong một lớp electron.
- Các electron trên cùng một phân lớp có mức năng lượng bằng nhau.
- Các phân lớp được ký hiệu bằng các chữ cái thường là s, p, d, f.
Số phân lớp trong mỗi lớp bằng số thứ tự của nó.
- Lớp thứ nhất có một phân lớp, đó là phân lớp 1s
- Lớp thứ hai có hai phân lớp, đó là các phân lớp 2s và sp
- Lớp thứ ba có ba phân lớp, đó là các phân lớp 3s, 3p và 3d
- Lớp thứ tư có bốn phân lớp, đó là các phân lớp 4s, 4p, 4d và 4f
Các electron ở phân lớp s được gọi là các electron s, ở phân lớp p được gọi là các electron p.
III – Số electron tối đa trong một lớp và một phân lớp
Số electron tối đa trong một phân lớp như sau:
- Phân lớp s chứa tối đa 2 electron
- Phân lớp p chứa tối đa 6 electron
- Phân lớp d chứa tối đa 10 electron
- Phân lớp f chứa tối đa 14 electron
Phân lớp electron đã chứa đủ số electron tối đa được gọi là phân lớp electron bão hòa.
Số electron tối đa trong một lớp được suy ra từ giả thuyết trên:
- Lớp thứ nhất (lớp K, n=1) có 1 phân lớp 1s, chứa tối đa 2 electron
- Lớp thứ hai (lớp L, n=2) có 2 phân lớp 2s và 2p nên chứa tối đa 8 electron
- Lớp thứ ba (lớp M, n=3) có 3 phân lớp 3s, 3p và 3d nên chứa tối đa 18 electron
- Lớp thứ tư (lớp N, n=4) có 4 phân lớp 4s, 4p, 4d và 4f nên chứa tối đa 32 electron
Do đó: Số electron tối đa của lớp thứ n là 2n2
Lớp electron đã chứa đầy electron thì được gọi là lớp electron bão hòa.
| Lớp electron | Số electron tối đa của lớp | Phân bố electron trên các phân lớp |
| Lớp K (n=1) | 2 | 1s2 |
| Lớp L (n=2) | 8 | 2s22p6 |
| Lớp M (n=3) | 18 | 3s23p63d10 |
| Lớp N (n=4) | 32 | 4s24p64d104f14 |
Sơ đồ cấu tạo vỏ nguyên tử: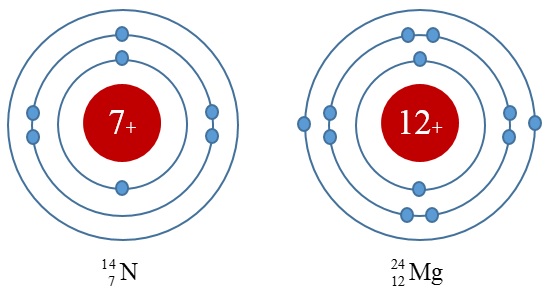
Sơ đồ phân bố electron trên các lớp của nguyên tử Nitơ và Magie
- Cấu hình electron của Nitơ: 1s22s22p5
- Cấu hình electron của Magie: 1s22s22p63s2
BÀI TẬP CẤU TẠO VỎ NGUYÊN TỬ
Bài 1. Một nguyên tử M có 75 electron và 110 nơtron. Kí hiệu của nguyên tử M là
| A. 18575M | B. 75185M | C. 11075M | D. 75110M |
Chọn đáp án đúng.
Giải: Kí hiệu của nguyên tử M bao gồm số khối (A) nằm ở trên và số hiệu nguyên tử (Z) nằm ở dưới.
A = số proton + số nơtron = số electron + số nơtron = 75 + 110 = 185
Z = số proton = số electron = 75
=> Chọn đáp án A
Bài 2. Nguyên tử nào trong các nguyên tử sau đây chứa đồng thời 20 nơtron, 19 proton và 19 electron?
| A. 3717Cl | B. 3919K | C. 4018M | D. 4019M |
Chọn đáp án đúng.
Giải: cũng bằng cách lập luận như bài 1, ta có thể tìm ra đáp án.
- Số khối A = số nơtron + số proton = 39 (kí hiệu ở trên nguyên tử)
- Số hiệu hạt nhân Z = số proton = 19 (kí hiệu ở dưới)
=> Chọn đáp án B
Bài 3. Số đơn vị điện tích hạt nhân của nguyên tử flo là 9. Trong nguyên tử flo, số electron ở phân mức năng lượng cao nhất là
| A. 2 | B. 5 | C. 9 | D. 11 |
Chọn đáp số đúng.
Giải: Đầu tiên chúng ta hãy điền đầy các electron từ lớp thứ nhất (lớp K) đến lớp thứ n, cho đến khi hết 9 electron của nguyên tử flo.
Sau khi điền xong ta có kết quả cấu hình electron của flo là 1s22s22p5. Do đó, số electron ở phân mức năng lượng cao nhất nằm ở phân lớp p của lớp thứ hai.
=> Chọn đáp án B
Bài 4. Các electron của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ ba có 6 electron. Số đơn vị điện tích hạt nhân nguyên tử của nguyên tố X là
| A. 6 | B. 8 | C. 14 | D. 16 |
Chọn đáp án đúng.
Giải: Nguyên tố X có số electron phân bố trên 3 lớp, vậy thì lớp thứ nhất và lớp thứ hai sẽ bão hòa.
- Tổng số electron ở hai lớp electron bão hòa (lớp K và lớp L) = 2 + 8 = 10 electron
- Theo đề bài số electron ở lớp thứ 3 là 6 electron
Vậy tổng số electron ở 3 lớp là 16 electron.
=> Chọn đáp án D
Bài 5. a) Thế nào là lớp và phân lớp electron? Sự khác nhau giữa lớp và phân lớp electron?
b) Tại sao lớp N chứa tối đa 32 electron?
Giải:
a) Lớp electron chứa các electron có mức năng lượng gần bằng nhau.
Phân lớp electron chứa các electron có mức năng lượng bằng nhau.
Sự khác nhau giữa lớp và phân lớp electron:
- Lớp electron chứa các phân lớp electron. Lớp electron là tập cha, còn phân lớp electron là tập con (theo ý nghĩa toán học).
- Nằng lượng của electron trên cùng phân lớp thì bằng nhau, nhưng trên cùng 1 lớp thì có thể bằng nhau hoặc gần bằng nhau.
b) Lớp N chứa tối đa 32 electron là vì:
Cách thứ nhất:
Lớp N là lớp thứ n=4. Do đó, lớp này có chứa 4 phân lớp là 4s, 4p, 4d, 4f. Mỗi phân lớp chứa số lượng electron tối đa như sau:
- Phân lớp 4s: 2 electron
- Phân lớp 4p: 6 electron
- Phân lớp 4d: 10 electron
- Phân lớp 4f: 14 electron
Cộng tất cả số electron trên ta có tất cả 32 electron.
Cách thứ hai:
Từ công thức tính số electron tối đa trên lớp thứ n (trang 21, trong SGK Hóa Học 10): 2n2
Lớp N (n=4) có 2×42 = 32 electron
Bài 6. Nguyên tử agon có kí hiệu là 4018Ar.
a) Hãy xác định số proton, số nơtron và số electron của nguyên tử.
b) Hãy xác định sự phân bố electron trên các lớp electron.
Giải:
a) Số proton của nguyên tử 4018Ar: 18
Số nơtron của nguyên tử 4018Ar: 22
Số electron của nguyên tử 4018Ar: 18
b) Sự phân bố electron trên các lớp hay còn gọi là cấu hình electron nguyên tử 4018Ar: 1s22s22p63s23p6
Cung cấp thêm thông tin: sự phân bố electron của 4018Ar cho thấy tất cả 3 lớp electron đều bão hòa. Đây là cấu hình chung cho khí hiếm (khí hiếm tương đối trơ về mặt hóa học).