Cách viết cấu hình electron nguyên tử được xây dựng dựa trên lý thuyết và kết quả thực nghiệm về thứ tự các mức năng lượng của electron nguyên tử. Do đó, trước khi vào trực tiếp hướng dẫn viết cấu hình electron nguyên tử chúng ta hãy đến với lý thuyết về mức năng lượng electron nguyên tử.
CÁCH VIẾT CẤU HÌNH ELECTRON NGUYÊN TỬ
Bài viết này sẽ giúp các bạn trả lời các câu hỏi sau đây:
- Sự sắp xếp các electron trong vỏe nguyên tử các nguyên tố như thế nào?
- Cấu hình electron nguyên tử là gì?
- Cách viết cấu hình electron nguyên tử
- Đặc điểm của lớp electron ngoài cùng
I – Thứ tự các mức năng lượng trong nguyên tử
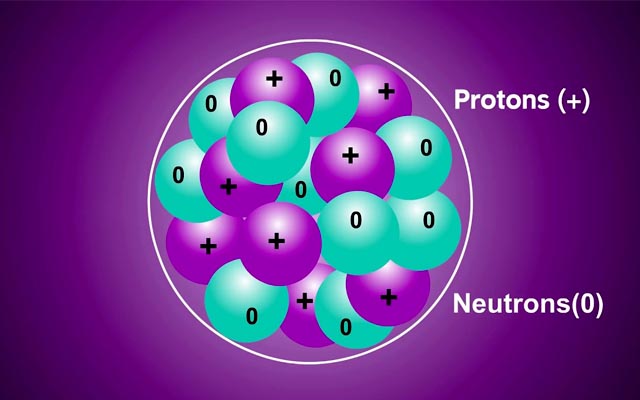
Các electron trong các nguyên tử ở trạng thái cơ bản lần lượt chiếm các mức năng lượng từ thấp đến cao.
Mức năng lượng ở các lớp tăng theo thứ tự từ 1 đến 7
Mức năng lượng ở các phân lớp tăng theo thứ tự s, p, d, f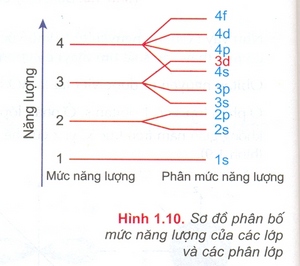
Như vậy thì electron sẽ được điền vào các lớp và phân lớp theo thứ tự: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s
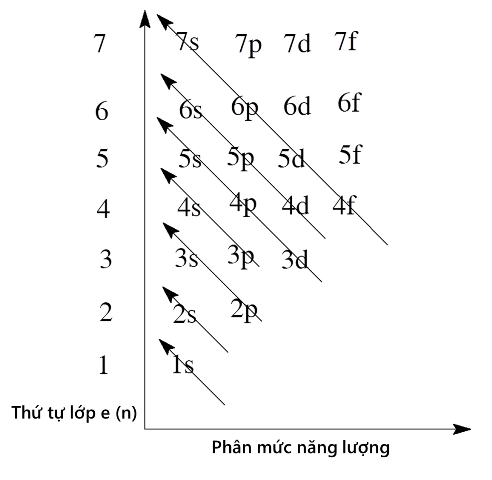
II – Cấu hình electron nguyên tử
1. Cấu hình electron nguyên tử
Cấu hình electron nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
Quy ước cách viết cấu hình electron nguyên tử:
- Số thứ tự các lớp được ghi bằng số 1, 2, 3, 4, …
- Phân lớp được kí hiệu bởi các chữ cái s, p, d, f
- Số electron trên một phân lớp được ghi bằng số ở phí trên bên phải kí hiệu phân lớp (s2, p6 , d10, …)
Cách viết cấu hình electron nguyên tử:
Bước 1: Xác định số electron nguyên tử
Bước 2: Điền số electron tối đa vào từng phân lớp theo thứ tự mức năng lượng tăng dần (1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s…)
Bước 3: Viết cấu hình electron nguyên tử
Ví dụ: H là 1s1, Li là 1s22s1, Cl là 1s22s22p63s23p5
Cấu hình electron viết gọn: Cl là [Ne]3s23p5. Trong đó Ne là nguyên tử khí hiếm đứng trước Cl
=> Nguyên tử của nguyên tố có electron cuối cùng được điền vào các phân lớp s, p, d, f thì nguyên tố đó được gọi là nguyên tố s, p, d, f.
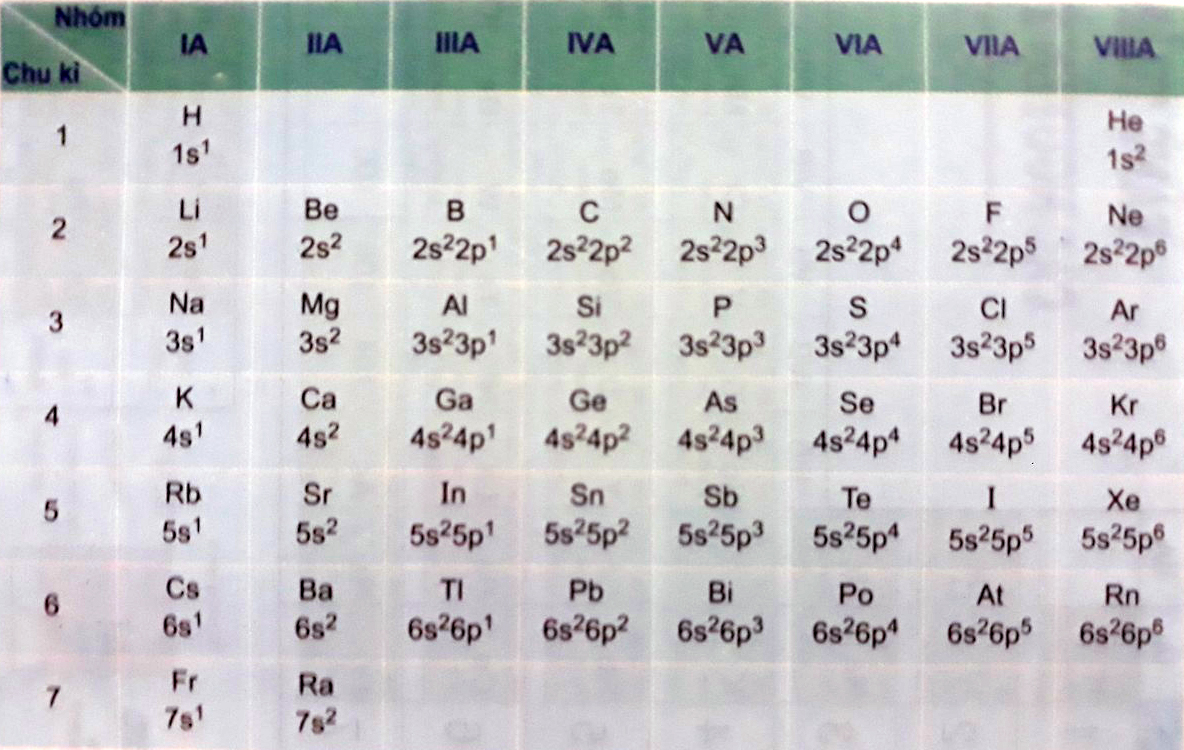
2. Cấu hình electron nguyên tử của 20 nguyên tố đầu
Dưới đây là bảng cấu hình electron nguyên tử của 20 nguyên tố đầu tiên trong bảng tuần hoàn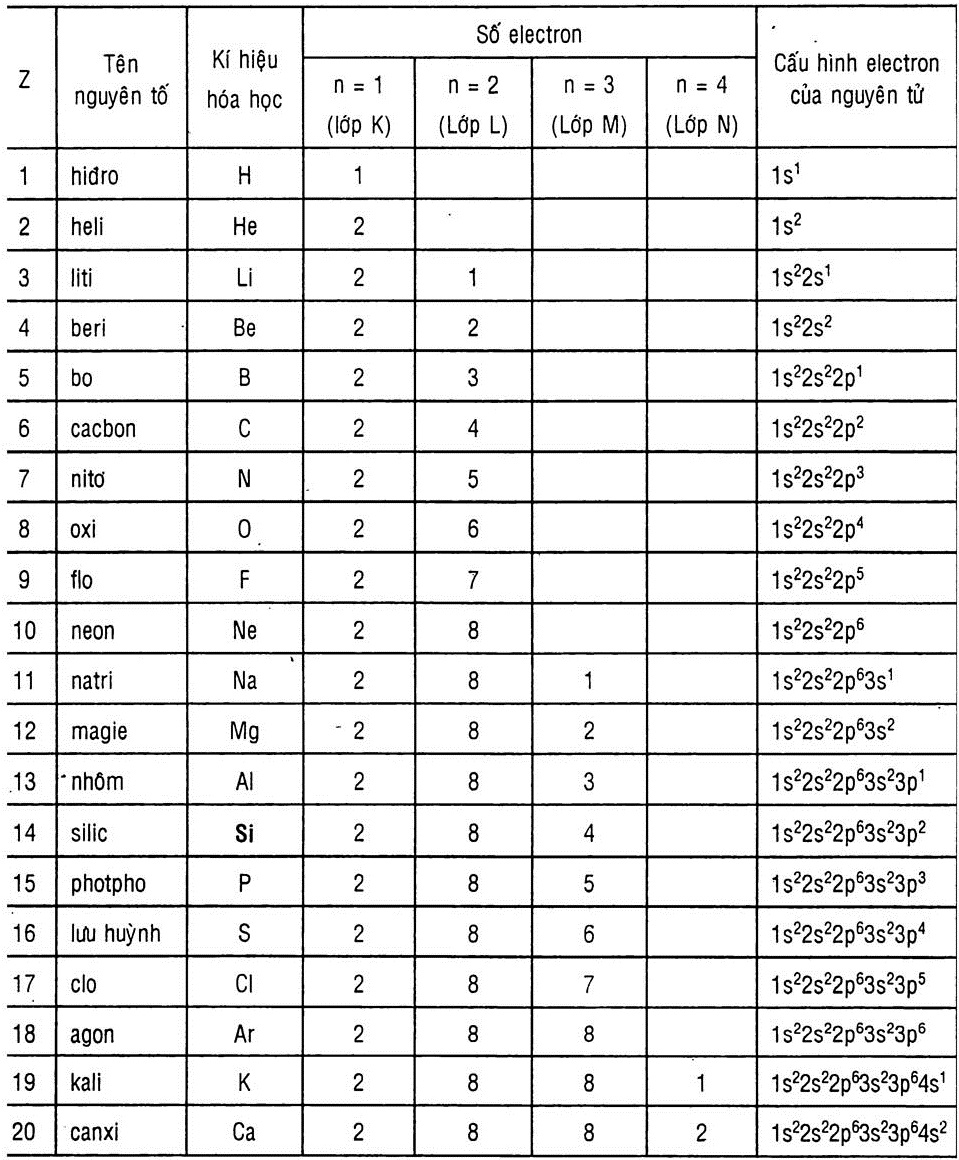
3. Đặc điểm của lớp electron ngoài cùng
Dựa vào số electron của lớp ngoài cùng chúng ta có thể biết được loại nguyên tố. Do đó, có thể nói khi biết cấu hình electron của nguyên tử có thể dự đoán được loại nguyên tố. Chúng ta hãy xem lý giải về việc này ngay dưới đây.
Tất cả các nguyên tử của các nguyên tố, lớp electron ngoài cùng có tối đa 8 electron
Các nguyên tử của nguyên tố có 8 electron ngoài cùng là nguyên tố khí hiếm. Các nguyên tử của nguyên tố khí hiếm rất bền, trơ về mặt hóa học (không tham gia vào các phản ứng hóa học ở điều kiện thường).
– Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng dễ nhường electron, đây là các nguyên tử của nguyên tố kim loại.
– Các nguyên tử có 5, 6, 7 electron ở lớp ngoài cùng dễ nhận electron, đây là các nguyên tử của nguyên tố phi kim.
– Các nguyên tử có 4 electron ở lớp ngoài cùng có thể là nguyên tử của nguyên tố phi kim hoặc kim loại. Những nguyên tử này thường có tính chất lưỡng tính (có cả tính chất của phi kim và kim loại).
BÀI TẬP CẤU HÌNH ELECTRON NGUYÊN TỬ
Bài 1. Nguyên tố có Z =11 thuộc loại nguyên tố
| A. s | B. p | C. d | D. f |
Chọn đáp án đúng.
Giải:
Z = 11, suy ra nguyên tử của nguyên tố này có 11 electron. Ta viết cấu hình electron của nguyên tố này để tìm electron cuối nằm trên phân lớp nào.
Cấu hình nguyên tố (Z = 11): 1s22s22p63s1
=> electron cuối cùng nằm trên phân lớp s nên ta chọn đáp án A
Bài 2. Cấu hình electron của nguyên tử lưu huỳnh (Z = 16) là
A. 1s22s22p63s23p5
B. 1s22s22p63s23p6
C. 1s22s22p63s23p4
D. 1s22s22p63s23p3
Chọn đáp án đúng.
Giải:
Đề bài cho chúng ta biết Z = 16, đó cũng là số electron của nguyên tử lưu huỳnh. Ta chỉ cần kiểm tra tổng số electron trong đáp án và cách điền số electron vào phân lớp có theo quy tắc năng lượng tăng dần hay không.
Trong số 4 đáp án trên chỉ có đáp án C là có đúng 11 electron, nên ta chọn đáp án C không cần quan tâm đến cách xếp electron có đúng quy tắt hay không.
Bài 3. Cấu hình electron của nguyên tử nhôm (Z =13) là 1s22s22p63s23p1
Vậy:
A. Lớp thứ nhất (lớp K) có 2 electron
B. Lớp thứ hai (lớp L) có 8 electron
C. Lớp thứ ba (lớp M) có 3 electron
D. Lớp ngoài cùng có 1 electron
Tìm câu sai.
Giải:
Lớp thứ ba có 2 phân lớp 3s và 3p. Tổng số electron của 2 phân lớp này là 3 electron
=> Chọn đán án D
Bài 4. Tổng số hạt proton, nơtron và electron trong nguyên tử của một nguyên tố là 13.
a) Xác định nguyên tử khối.
b) Viết cấu hình electron nguyên tử của nguyên tố đó.
(Cho biết: Các nguyên tố có số hiệu nguyên tử từ 2 đến 82 trong bảng tuần hoàn thì 1 ≤ (N/Z) ≤ 1,5)
Giải:
Theo đề bài ta có: N + P + e = 13 => N + 2Z = 13 (vì Z = P = e) => N = 13 -2Z
Kết hợp với điều kiện 1 ≤ (N/Z) ≤ 1,5 <=> Z ≤ N ≤ 1.5 Z
Thay N = 13 -2Z vào Z ≤ N ≤ 1.5 Z và rút gọn hệ bất đẳng thức này ta được: 3.714 ≤ Z ≤ 4.333
Như vậy thì Z = 4
a) Nguyên tử khối A = Z + N = 4 + (13 – 2×4) = 9
b) Số electron của nguyên tử bằng với số hiệu hạt nhân nguyên tử. Do đó, tổng số electron bằng 4.
Cấu hình electron nguyên tử này là: 1s22s2
Bài 5. Có bao nhiêu electron ở lớp ngoài cùng trong nguyên tử của các nguyên tố có số hiệu nguyên tử lần lượt bằng 3, 6, 9, 18?
Giải:
- Cấu hình electron nguyên tử có tổng electron bằng 3: 1s22s1
=> Có 1 electron lớp ngoài cùng
- Cấu hình electron nguyên tử có tổng electron bằng 6: 1s22s22p2
=> Có 4 electron lớp ngoài cùng
- Cấu hình electron nguyên tử có tổng electron bằng 9: 1s22s22p5
=> Có 7 electron lớp ngoài cùng
- Cấu hình electron nguyên tử có tổng electron bằng 18: 1s22s22p63s23p6
=> Có 8 electron lớp ngoài cùng
Bài 6. Viết cấu hình electron nguyên tử của các cặp nguyên tố mà hạt nhân nguyên tử có số proton là:
a) 1, 3
b) 8, 16
c) 7, 9
Những nguyên tố nào là kim loại? Là phi kim? Vì sao?
Giải:
a)
P = 1, 1s1 có 1 electron lớp ngoài cùng nên là nguyên tố kim loại;
P =3, 1s22s1 có 1 electron lớp ngoài cùng nên là nguyên tố kim loại;
b)
P = 8, 1s22s22p4 có một 6 lớp ngoài cùng nên là nguyên tố phi kim;
P =16, 1s22s22p63s23p4 có 6 electron lớp ngoài cùng nên là nguyên tố phi kim;
c)
P = 7, 1s22s22p3 có 5 electron lớp ngoài cùng nên là nguyên tố phi kim;
P =9, 1s22s22p5 có 7 electron lớp ngoài cùng nên là nguyên tố phi kim;