Mưa axit là hiện tượng hóa học gây nguy hại rất lớn cho con người và môi trường sống. Vậy khái niệm mưa axit là gì? Sự hình thành của mưa axit, nguyên nhân gây ra mưa axit là gì? Các phản ứng hóa học xảy ra như thế nào? Ảnh hưởng của hiện tượng này như thế nào? Các bạn cùng Từ Điển Hóa Học tìm hiểu mưa axit là gì nhé.
Ngày nay, hiện tượng hiệu ứng nhà kính, hiện tượng mưa axit và những tác hại của nó đă gây nên những hậu quả nghiêm trọng, đặc biệt là ở những nước công nghiệp phát triển. Vấn đề ô nhiễm môi trường luôn được cả thế giới quan tâm. Việt Nam chúng ta đang rất chú trọng đến vấn đề này. Hôm nay hóa học sẽ chia sẻ kiến thức mưa axit đầy đủ và chi tiết nhất.
1. Mưa axit là gì?
Mưa axit (Acid rain hay axit rain) còn được biết đến là sự lắng đọng axit. Là hiện tượng mưa mà trong nước mưa có độ pH dưới 5,6 được tạo ra bởi lượng khí thải SO2 và NOx từ các quá trình phát triển sản xuất con người tiêu thụ nhiều than đá, dầu mỏ và các nhiên liệu tự nhiên khác.
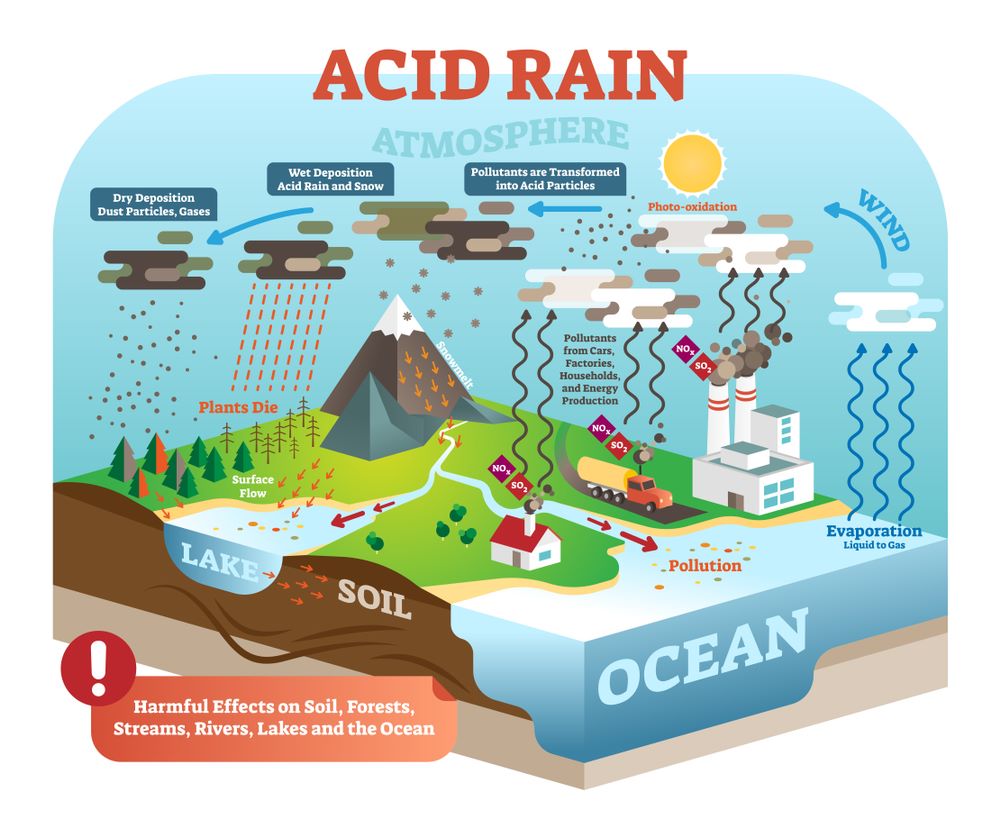 Mưa axit (Acid rain hay axit rain)
Mưa axit (Acid rain hay axit rain)
Tính axit của nước mưa chủ yếu là do hàm lượng axit được tạo ra bởi lượng khí thải SO2 và NO (đó là 2 axit mạnh axit sunfuric (H2SO4) và axit nitric (HNO3)) từ các nhà máy điện, ô tô và các trung tâm công nghiệp. Ngoài ra, các hiện tượng tự nhiên cũng phát sinh một lượng ít khí thải này.
Mưa axit được phát hiện ra đầu tiên năm 1948 tại Thuỵ Điển nơi có rất nhiều mỏ than. Đến năm 1960 thì các nhà khoa học mới bắt đầu quan sát và nghiên cứu về hiện tượng này. Và thuật ngữ “mưa axit” được đặt ra bởi Robert Angus Smith vào năm 1972.
2. Sự hình thành của mưa axit
Trên phương diện hóa học, mưa axit chính là sự ngưng tụ của acid dưới hình thái của một cơn mưa. Là là hiện tượng trong nước mưa, lượng axit có chứa thành phần chủ yếu là axit từ Nitơ và lưu huỳnh.
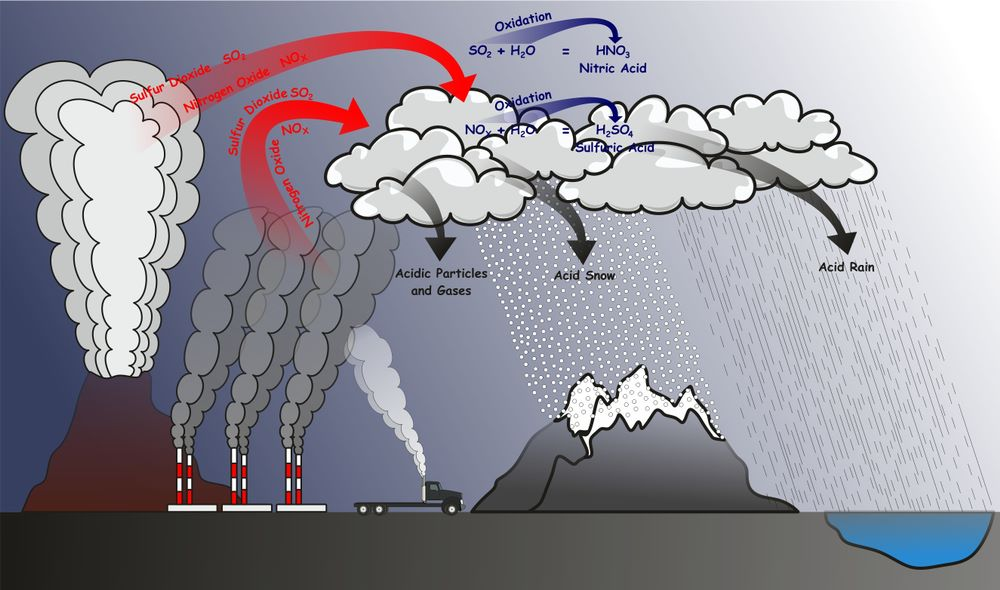
Sự hình thành của mưa axit
Đây là do sự kết hợp của các oxit phi kim và nước. Các loại SO2, NO, NO2 trong bầu khí quyển, kết hợp cùng nước mưa. Khí này là oxit axit hòa tan trong nước hình thành các dung dịch có độ pH thấp. Sự tích tụ thành axit sunfuric (H2SO4) và axit nitric (HNO3).
 Thang đo pH của mưa axit
Thang đo pH của mưa axit
Trong hóa học, dung dịch Axit có pH nó nhỏ hơn 7 (pH=7 là nước trung tính). Mưa axit có chứa hàm lượng axit. Giá trị pH thông thường mưa axit có pH dưới 5,6.
2.1. Các phản ứng hoá học của hiện tương mưa axit
Khí thải công nghiệp và khí thải của các động cơ đốt trong (ô tô, xe máy…) có chứa các khí SO2, NO, NO2,… Các khí này tác dụng với oxi O2 và hơi nước trong không khí nhờ xúc tác oxit kim loại (có trong khói, bụi nhà máy) hoặc ozon tạo ra axit sunfuric H2SO4 và axit nitric HNO3. Cho nên các phản ứng hóa học chủ yếu xảy ra của mưa axit là phản ứng của lưu huỳnh và nito.
Các phản ứng của nguyên tố phi kim chứa Lưu huỳnh:
– Quá trình đốt cháy lưu huỳnh trong khí oxi sẽ sinh ra lưu huỳnh điôxit. Khí lưu huỳnh đioxit khi cháy trong không khí sẽ tạo thành SO3 (lưu huỳnh triôxit). Theo phương trình hóa học sau:
S + O2 → SO2;
2SO2 + O2 → 2SO3;
Lưu huỳnh triôxít gặp hơi nước sẽ tạo ra axit sunfuric H2SO4. Đây chính là một trong những thành phần chủ yếu của mưa axit.
SO3 (k) + H2O (l) →H2SO4 (l);
Các phản ứng của nguyên tố phi kim chứa Nitơ:
– Nitơ cháy trong không khí oxi sẽ tạo ra khi NO. khí NO khi tiếp tục cháy trong không khí sẽ tạo ra NO2.
N2 + O2 → 2NO;
2NO + O2 → 2NO2;
3NO2 (k) + H2O (l) → 2HNO3 (l) + NO (k);
– Khí NO2 gặp hơi nước sẽ tạo ra axit nitric. Axít nitric HNO3 và axit sunfuric H2SO4 chính là thành phần của mưa axit.
2.2. Nguyên nhân của mưa axit
Nguyên nhân chính dẫn đến sự “axit hóa” các giọt nước mưa chủ yếu đến từ hoạt động của con người. Điển hình như việc đốt các nhiên liệu hóa thạch (than, dầu, khí thiên nhiên…) hoặc quá trình nung chảy quặng kim loại.
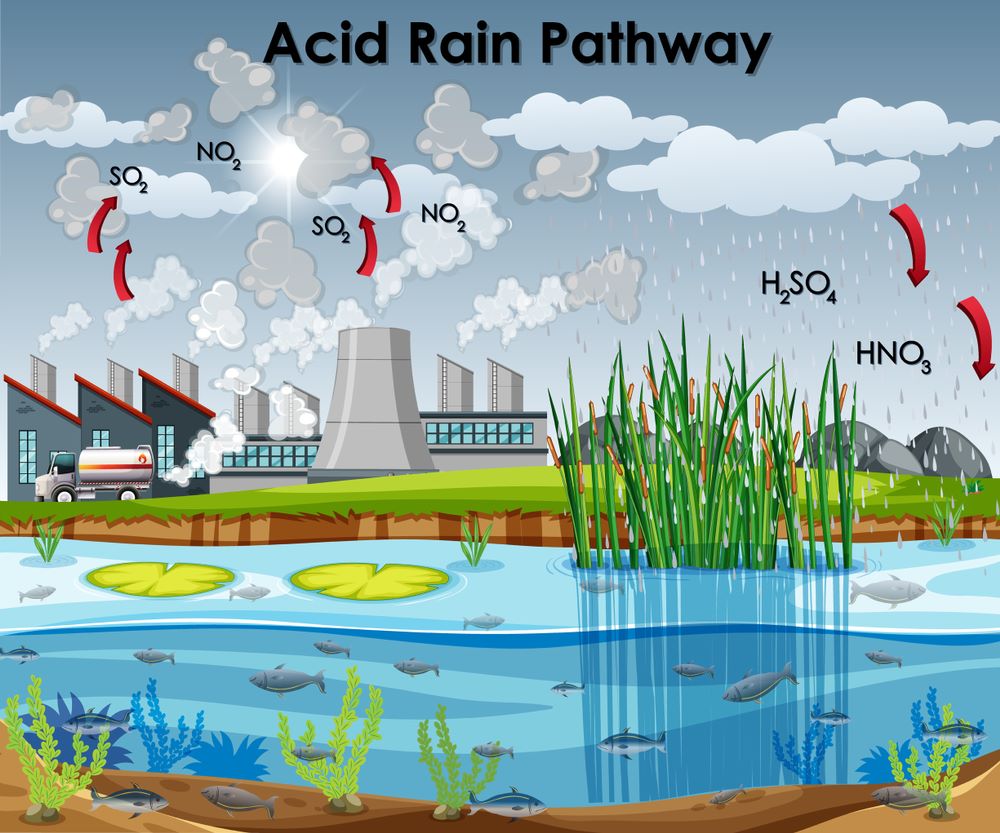 Sự phá hủy điều kiện môi trường của con người gây mưa axit
Sự phá hủy điều kiện môi trường của con người gây mưa axit
Nước có sẵn trong tự nhiên, còn các oxit được thải ra từ hoạt động của con người. Đặc biệt là việc sử dụng các loại nhiên liệu như than đá, dầu mỏ và các nhiên liệu tự nhiên khác… (phần lớn lượng oxit phi kim đến từ khí thải của các nhà máy công nghiệp). Và điều đó dẫn đến kết quả là những cơn mưa chứa đầy chất axit.
Bên cạnh nhân tố con người, một nguyên nhân khác dẫn đến mưa axit chính là do sự phun trào núi lửa. Khi đó, một lượng lớn khí SO2, NO, NO2…, đóng vai trò chính cho việc tạo thành mưa axit, cũng được thải ra môi trường.
3. Tác hại của mưa axit
– Hiện nay mưa axit là nguồn ô nhiễm chính ở một số nơi trên thế giới. Mưa axit làm hư hỏng các tượng đài làm từ đá cẩm thạch, đá vôi (các loại đá này thành phần chính là CaCO3):
CaCO3 + H2SO4 → CaSO4 + CO2↑ + H2O
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2↑ + H2O
– Ảnh hưởng trực tiếp đến sức khỏe con người: việc sử nước mưa có chứa nhiều axit như là tắm rửa, giặt…. cũng sẽ gây viêm da, mẩn ngứa, nấm. Khi dùng nước mưa axit thì ảnh hưởng đến hệ tiêu hóa. Bên cạnh đó người có thể mắc các bệnh về đường hô hấp như ho gà, hen suyễn. Hoặc các bệnh khác như nhức đầu, đau họng, đau mắt… Các kim loại nặng có thể xâm nhập vào cơ thể, gián tiếp hấp thụ và tích tụ kim loại trong cơ thể khi sử dụng các thực phẩm bị nhiễm kim loại.
– Quá trình ăn mòn vật liệu như sắt, đồng, kẽm… sắt, đồng, kẽm…khiến chúng bị giảm tuổi thọ. Gây thiệt hại lớn đến nền kinh tế trên toàn thế giới.
 Ăn mòn kim loại
Ăn mòn kim loại
– Các hạt sulphate, nitrate tạo thành trong khí quyển do quá trình mưa axit hình thành. Các hóa chất này gây ra ô nhiễm không khí và ảnh hưởng đến tầm nhìn trên khí quyển.
– Mưa axit gây ảnh hưởng trầm trọng đến hệ sinh thái tự nhiên. Mưa chứa axit làm giảm pH của nước ao, hồ, đất đai,.. làm điều kiện sống của động thực vật gặp nhiều khó khăn, thậm chí hủy diệt chúng.
 Mưa axit gây ảnh hưởng trầm trọng đến hệ sinh thái tự nhiên
Mưa axit gây ảnh hưởng trầm trọng đến hệ sinh thái tự nhiên
– Mưa axit làm tăng mức độ ô nhiễm kim loại nặng tăng cao. Axit hòa tan kim loại nặng như chì, hòa tan vào môi trường. Qua đó gây ngộ độc cho sinh vật cũng như đe dọa cuộc sống con người
– Nước mưa chứa axit rơi xuống có thể ngấm vào đất và làm tăng độ chua của đất. Từ đó gây ảnh hưởng nghiêm trọng đến đời sống sinh vật và hệ cân bằng sinh thái.
4. Lời kết
Trên đây, hiện tượng mưa axit là gì? mưa axit là chất gì? sự tạo thành mưa axit, nguyên nhân và tác hại của mưa axit. Kiến thức này áp dụng kiến thức môn hóa học vào giải thích hiện tượng đời sống thực tiễn. Hy vọng mang đến những kiến thức hữu ích giúp các bạn học tốt hơn. Chúc các bạn học tốt.