Như chúng ta đã biết, các nguyên tố phi kim như hidro, oxi, nitơ, cacbon… có rất nhiều ứng dụng trong đời sống hàng ngày và trong sản xuất. Phi kim có những tính chất vật lý và hóa học nào? Chúng tồn tại ở những trạng thái nào trong tự nhiên? Chúng tác dụng và không tác dụng với những chất nào và mức độ hoạt động hóa học của chúng ra sao? Để hiểu rõ hơn về điều này, chúng ta cùng tìm hiểu bài viết hôm nay các bạn nhé! Nào, bây giờ chúng ta cùng tìm hiểu những tính chất vật lý và hóa học của phi kim xem chúng có gì đặc biệt không nhé!
tinh-chat-vat-ly-va-hoa-hoc-cua-phi-kim
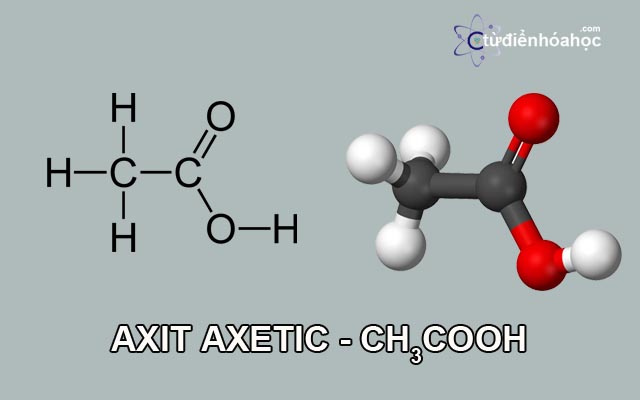
Tính chất vật lý và hóa học của phi kim
1. Tính chất vật lý của phi kim
Ở điều kiện bình thường, phi kim có thể tồn tại ở cả 3 trạng thái là rắn, lỏng và khí.
- Trạng thái rắn: cacbon (C), photpho (P), lưu huỳnh (P)…
- Trạng thái lỏng: brom (Br2)
- Trạng thái khí: hidro (H2), nito (N2), oxi (O2), flo (F2), clo (Cl2)…
Đa số các nguyên tố phi kim không dẫn nhiệt và dẫn điện. Nhiệt độ nóng chảy của phi kim thấp. Clo, brom và iot là những phi kim có tính độc.
2. Tính chất hóa học của phi kim
Những tính chất hóa học của phi kim là gì? Chúng ta cùng tìm hiểu những tính chất đó ngay sau đây nhé!
a) Tác dụng với kim loại
Nhiều phi kim có thể tác dụng với một số kim loại tạo thành muối.
Phi kim + Kim loại → Muối
Fe + S (t°) → FeS
Ca + Cl2 (t°) → CaCl2
2Al + 3Br2 (t°) → 2AlBr3
6Li + N2 → 2Li3N
Riêng oxi tác dụng với kim loại tạo thành oxit bazơ.
O2 + Kim loại → Oxit bazơ
4Na + O2 (t°) → 2Na2O
2Pb + O2 (t°) → 2PbO
3Fe + 2O2 (t°) → Fe3O4
2Cu + O2 (t°) → 2CuO
b) Tác dụng với hidro
Nhiều phi kim tác dụng với khí hidro tạo thành chất khí.
Phi kim + H2 → Chất khí ↑
C + 2H2 (t°) → CH4 ↑
O2 + 2H2 (t°) → 2H2O (hơi nước) ↑
Cl2 + H2 (t°) → 2HCl ↑
S + H2 (t°) → H2S ↑
c) Tác dụng với oxi
Nhiều phi kim tác dụng với O2 tạo thành oxit axit.
Phi kim + O2 → Oxit axit
4P + 5O2 (t°) → 2P2O5
S + O2 (t°) → SO2
C + O2 (t°) → CO2
Một số phi kim quen thuộc

tinh-chat-vat-ly-va-hoa-hoc-cua-phi-kim-2
3. Mức độ hoạt động hóa học của phi kim
Dựa vào khả năng và mức độ phản ứng của phi kim với kim loại và hidro, người ta đánh giá mức độ hoạt động hóa học mạnh hay yếu của phi kim. Flo, oxi, clo là những phi kim hoạt động mạnh. Trong đó, flo là phi kim hoạt động hóa học mạnh nhất. Cacbon, nito, photpho, lưu huỳnh… là những phi kim hoạt động yếu hơn.
Giải bài tập tính chất vật lý và hóa học của phi kim
Câu 1. Hãy chọn câu trả lời đúng trong các câu sau đây:
a) Phi kim dẫn điện tốt
b) Phi kim dẫn nhiệt tốt
c) Phi kim chỉ tồn tại ở 2 trạng thái: rắn và khí
d) Phi kim dẫn điện, dẫn nhiệt kém
Đáp án đúng: d.
Câu 2. Viết các PTHH của S, C, Cu, Zn với khí oxi. Cho biết các oxit tạo thành thuộc loại nào? Viết CTHH các axit hoặc bazơ tương ứng với mỗi oxit đó.
Bài làm:
S + O2 (t°) → SO2 (Lưu huỳnh đioxit) → Oxit axit → H2SO3 là axit tương ứng.
C + O2 (t°) → CO2 (Cacbon đioxit) → Oxit axit → H2CO3 là axit tương ứng.
2Cu + O2 (t°) → 2CuO (Đồng (II) oxit) → Oxit bazơ → Cu(OH)2 là bazơ tương ứng.
2Zn + O2 (t°) → 2CuO (Kẽm oxit) → Oxit bazơ → Zn (OH)2 là bazơ tương ứng.
Câu 3. Viết các PTHH và ghi đầy đủ điều kiện khi cho H2 phản ứng với các phi kim sau đây:
a) Clo
b) Lưu huỳnh
c) Brom
Cho biết trạng thái của các sản phẩm tạo thành.
Bài giải:
a) H2 + Cl2 (t°) → 2HCl ↑
b) H2 + S (t°) → H2S ↑
c) H2 + Br2 (t°) → 2HBr ↑
Các chất tạo thành là chất khí.
Câu 4. Viết PTHH giữa các cặp chất sau đây, ghi rõ điều kiện phản ứng nếu có:
a) Khí flo và hidro
b) Lưu huỳnh và oxi
c) Bột sắt và bột lưu huỳnh
d) Cacbon và oxi
e) Khí hidro và lưu huỳnh
Bài làm:
a) F2 + H2 → 2HF ↑
b) S + O2 (t°) → SO2 ↑
c) Fe + S (t°) → FeS ↑
d) C + O2 (t°) → CO2 ↑
e) H2 + S (t°) → H2S ↑
Câu 5. Cho sơ đồ chuyển hóa sau:
Phi kim → oxit axit 1 → oxit axit 2 → axit → muối sunfat tan → muối sunfat không tan.
a) Tìm CT các chất thích hợp để thay cho tên trong sơ đồ trên.
b) Viết các PTHH của chuyển đổi trên.
Bài làm:
a) Công thức các chất cho chuỗi chuyển hóa là:
S → SO2 → SO3 → H2SO4 → FeSO4 → BaSO4.
b) Các PTHH của chuỗi phản ứng trên:
S + O2 (t°) → SO2 ↑
SO2 + O2 (t°) → SO3 ↑
SO3 + H2O → H2SO4
H2SO4 + Fe → FeSO4 + H2 ↑
FeSO4 + BaCl2 → BaSO4 ↓ + FeCl2
Câu 6. Nung một hỗn hợp gồm 5,6 gam Fe và 1,6 gam S trong môi trường không có không khí. Sau khi phản ứng kết thúc thu được hỗn hợp chất rắn A. Cho dd HCl 1M phản ứng vừa đủ với A thu được hỗn hợp khí B.
a) Viết các PTHH xảy ra.
b) Tính thể tích dd HCl đã tham gia phản ứng.
Bài làm:
a) Các PTHH xảy ra:
Hỗn hợp chất rắn A là FeS và Fe dư. Hỗn hợp khí B gồm các khí H2S và H2.
Fe + S (t°) → FeS (1)
FeS + 2HCl → FeCl2 + H2S ↑ (2)
Fe dư + 2HCl → FeCl2 + H2 ↑ (3)
b) Theo đề ra, ta có:
nFe = 5,6/56 = 0,1 (mol)
nS = 1,6/32 = 0,05 (mol)
Theo phương trình (1), ta có:
nFeS = 0,05
nFe dư = 0,1 – 0,05 = 0,05
Theo phương trình (2) và (3), ta có:
nHCl = 2nFeS + 2nFe dư = 2 x 0,05 + 2 x 0,05 = 0,2 (mol)
Thể tích dung dịch HCl 1M đã tham gia phản ứng là:
VHCl = nHCl/CM HCl = 0,2/1 = 0,2 (lít) = 200 ml