Cacbon là một phi kim khá quen thuộc và có nhiều ứng dụng quan trong trong đời sống, sản xuất. Cacbon là nguyên tố phổ biến trong hầu hết các sự sống hữu cơ. Vậy bạn đã hiểu gì về nguyên tố này. Hãy cùng chúng tôi tìm hiểu những tính chất hóa học của cacbon cũng như ứng dụng của nó. Bên cạnh đó là những dạng thù hình của cacbon các bạn nhé!

tinh-chat-hoa-hoc-cua-cacbon
I. Các dạng thù hình của Cacbon
1. Dạng thù hình là gì?
Các dạng thù hình của một nguyên tố hóa học là những đơn chất khác nhau do nguyên tố đó tạo nên. VD: nguyên tố oxi có 2 dạng thù hình là oxi O2 và ozon O3.
2. Các dạng thù hình của Cacbon
Cacbon có đến 8 dạng thù hình khác nhau, trong đó Cacbon vô định hình là hoạt động hóa học nhất.
Các dạng thù hình của cacbon
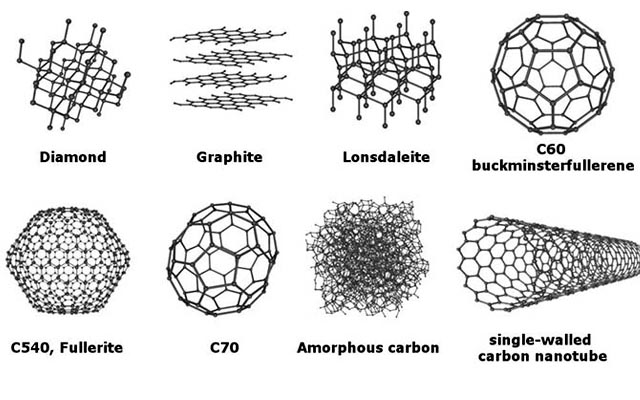
cac-dang-thu-hinh-cua-cacbon
- Kim cương
- Graphit
- Lonsdaleit
- C60 (Buckyball)
- C540
- C70
- Cacbon vô định hình
- Single – walled cacbon nanotube (Buckytube)
II. Tính chất của Cacbon
1. Tính chất hấp phụ của Cacbon
Than gỗ có khả năng giữ trên bề mặt của nó các chất khí, hơi, chất tan trong dung dịch. Do đó, than gỗ có tính hấp phụ.
Than hoạt tính

than-hoat-tinh
Than gỗ, than xương… mới điều chế có tính hấp phụ cao được gọi là than hoạt tính. Than hoạt tính có tác dụng làm trắng đường, chế tạo mặt nạ phòng độc… và nhiều ứng dụng quan trọng khác.
2. Tính chất hóa học của Cacbon
Cacbon có những tính chất hóa học của một phi kim. Đó là cacbon tác dụng được với kim loại, hidro. Do cacbon là phi kim hoạt động yếu nên các phản ứng hóa học với kim loại và hidro diễn ra khó khăn hơn. Ngoài những tính chất trên, cacbon còn khử được các oxit kim loại ở nhiệt độ cao tạo thành kim loại.
a) Cacbon tác dụng với oxi
Cacbon tác dụng với oxi tạo thành cacbon đioxit. Phản ứng tỏa nhiều nhiệt.
C + O2 (t°) → CO2
b) Cacbon tác dụng với hidro
Cacbon tác dụng với hidro ở nhiệt độ cao, áp suất thích hợp và có mặt của xúc tác Pt tạo thành khí metan.
C + 2H2 (t°, p, xt Pt) → CH4
c) Cacbon tác dụng với oxit kim loại
Cacbon khử được nhiều oxit kim loại ở nhiệt độ cao tạo thành kim loại.
2CuO + C (t°) → 2Cu + CO2
2ZnO + C (t°) → 2Zn + CO2
2PbO + C (t°) → 2Pb + CO2
III. Ứng dụng của cacbon
Cacbon có nhiều ứng dụng trong đời sống và sản xuất. Tùy vào dạng thù hình mà cacbon có những ứng dụng riêng như:
Kim cương

ung-dung-cua-cacbon
- Than chì: dùng để làm điện cực, ruột bút chì, chất bôi trơn…
- Kim cương: dùng để làm đồ trang sức, dao cắt kính, mũi khoan…
- Than hoạt tính: dùng làm mặt nạ phòng độc, chất hấp phụ, chất khử mùi, khử màu…
- Than đá, than gỗ: dùng lầm nhiên liệu, chất đốt, điều chế kim loại trong công nghiệp luyện kim…
IV. Giải bài tập về tính chất hóa học của Cacbon
Câu 1. Dạng thù hình của nguyên tố là gì? Cho 2 ví dụ.
Bài làm:
Các dạng thù hình của một nguyên tố hóa học là những đơn chất khác nhau do nguyên tố đó tạo nên.
Ví dụ:
- Nguyên tố oxi có 2 dạng thù hình là oxi O2 và ozon O3.
- Nguyên tố cacbon có 8 dạng thù hình, trong đó có 3 dạng chính là kim cương, than chì và cacbon vô định hình.
Câu 2. Viết PTHH của cacbon với các nguyên tố sau:
a) CuO
b) PbO
c) CO2
d) FeO
Bài làm:
a) 2CuO + C (t°) → 2Cu + CO2
b) 2PbO + C (t°) → 2Pb + CO2
c) CO2 + C (t°) → 2CO
d) 2FeO + C (t°) → 2Fe + CO2
Câu 3. Hãy xác định CTHH của các chất A, B, C, D trong thí nghiệm dưới đây. Nêu hiện tượng và viết phương trình phản ứng.
Bài làm:
– Các chất A, B, C, D lần lượt là: CuO, C, CO2, Ca(OH)2
– Hiện tượng của thí nghiệm: Chất rắn màu đen chuyển dần thành màu đỏ khi bị nung nóng và có khí thoát ra làm vẫn đục nước vôi trong.
– Phương trình hóa học:
2CuO + C (t°) → 2Cu + CO2
CO2 + Ca(OH)2 → CaCO3 + H2O
Câu 4. Tại sao người ta sử dụng than để đun nấu, nung gạch ngói, nung vôi lại gây ô nhiễm môi trường. Hãy nêu các biện pháp chống ô nhiễm môi trường và giải thích.
Bài làm:
Trong than có thành phần chính là Cacbon. Cacbon khi cháy trong O2 tạo ra khí CO2 và phản ứng tỏa nhiều nhiệt. Nhiệt lượng tỏa ra này có thể dùng để đun nấu, nung gạch ngói hay nung vôi.
Vì phản ứng đốt cháy Cacbon tạo ra khí CO2 nên nó gây ô nhiễm môi trường, hiệu ứng nhà kính, mưa axit…
Biện pháp chống ô nhiễm môi trường:
- Xử lý khí thải các lò nung gạch ngói, lò nung vôi… đồng thời cải tiến công nghệ ít gây ô nhiễm.
- Đặt các lò nung gây ô nhiễm ở xa khu dân cư.
- Trồng nhiều cây xanh để hấp thụ CO2.
- Sử dụng các loại bếp khác trong đun nấu như bếp điện, bếp gas…
Câu 5. Trong công nghiệp, người ta sử dụng cacbon để làm nhiên liệu. Tính nhiệt lượng toả ra khi đốt cháy 5 kg than chứa 90% cacbon, biết 1 mol cacbon cháy toả ra 394 kJ.
Bài làm:
Khối lượng C có trong 5 kg than là:
mC = 5 x 90/100 = 4,5 kg = 4500 gam
⇒ nC = mC/MC = 4500/12 = 375 (mol)
Nhiệt lượng tỏa ra khi đốt cháy 5 kg than là:
Q = 375 x 394 = 147750 (kJ)





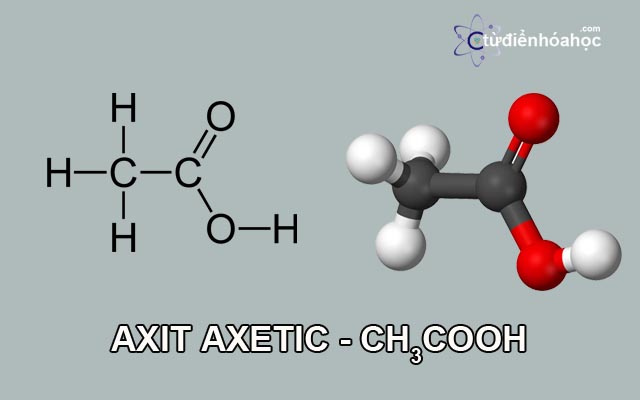














E xin bl là chỗ BT1, các dạng thù hình của Cacbon là 3 chứ ko phải là 8 ạ!