Axit cacbonic (H2CO3) và muối cacbonat có những tính chất và ứng dụng gì? Chúng ta sẽ cùng tìm hiểu hai hợp chất quan trọng của cacbon này nhé. Bên cạnh đó, chúng ta sẽ cùng tìm hiểu chu trình cacbon trong tự nhiên là gì? Mời các bạn cùng tham khảo!

axit-cacbonic-muoi-cacbonat-chu-trinh-cacbon-trong-tu-nhien
I. Axit cacbonic (H2CO3)
1. Trạng thái tự nhiên và tính chất vật lý của axit cacbonic
– Khí CO2 hòa tan trong nước mưa và nước tự nhiên: khoảng 90 cm3 khí CO2 hòa tan được trong 1000 cm3 nước.
– Một phần khí CO2 tác dụng với nước tạo thành dung dịch axit cacbonic. Phần lớn khí CO2 còn lại vẫn tồn tại trong khí quyển.
2. Tính chất hóa học của axit cacbonic
– Axit cacbonic là một axit yếu: nó làm đổi màu quỳ tím thành đỏ nhạt.
– Axit cacbonic là một axit kém bền: H2CO3 tạo thành trong các phản ứng hóa học dễ bị phân hủy ngay thành khí CO2 và nước.
II. Muối cacbonat
1. Phân loại muối cacbonat
Muối cacbonat có 2 loại:
- Muối cacbonat trung hòa (được gọi là muối cacbonat): Na2CO3, K2CO3, CaCO3, BaCO3, MgCO3…
- Muối cacbonat axit (được gọi là muối hiđrocacbonat): NaHCO3, KHCO3, Ca(HCO3)2, Ba(HCO3)2, Mg(HCO3)2…

canxi-cacbonat-CaCO3
2. Tính chất của muối cacbonat
a) Tính tan
– Đa số các muối cacbonat đều không tan trong nước, trừ một số muối cacbonat của kim loại kiềm: Na2CO3, K2CO3…
– Hầu hết các muối hiđrocacbonat đều tan trong nước: Ca(HCO3)2, Mg(HCO3)2…
b) Tính chất hóa học
– Tác dụng với axit:
Muối cacbonat tác dụng với axit tạo thành muối mới và giải phóng khí CO2.
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
NaHCO3 + HCl → NaCl + CO2 + H2O
– Tác dụng với dung dịch bazơ:
Một số muối cacbonat tác dụng với dung dịch bazơ tạo thành tạo thành muối cacbonat không tan và bazơ mới.
Na2CO3 + Ba(OH)2 → BaCO3 ↓ + 2NaOH
K2CO3 + Ca(OH)2 → CaCO3 ↓ + 2KOH
Muối hiđrocacbonat tác dụng với dung dịch kiềm tạo thành muối trung hòa và nước.
KHCO3 + KOH → K2CO3 + H2O
NaHCO3 + NaOH → Na2CO3 + H2O
– Tác dụng với dung dịch muối:
Dung dịch muối cacbonat có thể tác dụng với một số dung dịch muối tạo thành 2 muối mới.
Na2CO3 + BaCl2 → BaCO3 ↓ + 2NaCl
K2CO3 + Mg(NO3)2 → MgCO3 ↓ + 2KNO3
– Muối cacbonat bị nhiệt phân hủy:
Nhiều muối cacbonat (trừ muối cacbonat của kim loại kiềm như Na2CO3, K2CO3…) bị nhiệt phân hủy giải phóng khí CO2.
CaCO3 (t°) → CaO + CO2
2NaHCO3 (t°) → Na2CO3 + CO2 + H2O
3. Ứng dụng của muối cacbonat
Muối cacbonat có nhiều ứng dụng trong đời sống và sản xuất:
- CaCO3: thành phần chính của đá vôi, đá phấn được dùng làm nguyên liệu sản xuất xi măng, vôi…
- Na2CO3: dùng để sản xuất thủy tinh, nấu xà phòng…
- NaHCO3: dùng để sản xuất dược phẩm, hóa chất trong bình cứu hỏa…
III. Chu trình cacbon trong tự nhiên
Trong tự nhiên, cacbon luôn có sự chuyển hóa từ dạng này sang dạng khác. Sự chuyển hóa này xảy ra thường xuyên và liên tục tạo thành chu trình cacbon.
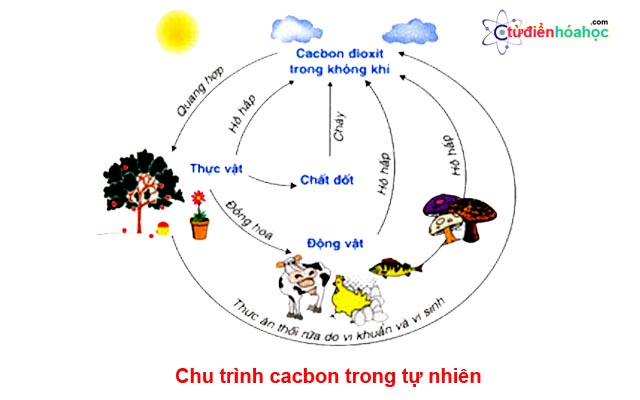
chu-trinh-cacbon-trong-tu-nhien
IV. Giải bài tập về axit cabonic và muối cacbonat
Câu 1. Hãy lấy VD chứng tỏ H2CO3 là axit yếu hơn HCl và là axit không bền. Viết PTHH.
Bài làm:
Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
Theo PTHH trên, ta thấy axit HCl đẩy được axit cabonic ra khỏi muối, đồng thời có khí CO2 thoát ra. Do đó có thể nói axit H2CO3 yếu hơn HCl và là axit không bền.
Câu 2. Dựa vào tính chất hoá học của muối cacbonat, hãy nêu tính chất của muối MgCO3 và viết các PTHH minh hoạ.
Bài làm:
Tính chất hóa học của muối cacbonat:
- Tác dụng với axit: MgCO3 + 2HCl → MgCl2 + CO2 ↑ + H2O
- Bị nhiệt phân hủy: MgCO3 (t°) → MgO + CO2
Câu 3. Viết các PTHH biểu diễn chuyển đổi hoá học sau:
C → CO2 → CaCO3 → CO2
Bài làm:
(1) C + O2 (t°) → CO2
(2) CO2 + CaO → CaCO3
(3) CaCO3 (t°) → CO2 + CaO
Câu 4. Hãy cho biết trong các cặp chất sau đây, những cặp nào có thể tác dụng với nhau.
a) H2SO4 và KHCO3
b) K2CO3 và NaCl
c) MgCO3 và HCl
d) CaCl2 và Na2CO3
e) Ba(OH)2 và K2CO3
Giải thích và viết các PTHH.
Bài làm:
a) H2SO4 + 2KHCO3 → K2SO4 + 2CO2 ↑ + 2H2O
b) K2CO3 + NaCl → không phản ứng
c) MgCO3 + 2HCl → MgCl2 + CO2 ↑ + H2O
d) CaCl2 + Na2CO3 → CaCO3 ↓ + 2NaCl
e) Ba(OH)2 + K2CO3 → BaCO3 ↓ + 2KOH
Câu 5. Hãy tính thể tích khí CO2 (ở đktc) tạo thành để dập tắt đám cháy nếu trong bình chữa cháy có dung dịch chứa 980 g H2SO4 tác dụng hết với dung dịch NaHCO3.
Bài làm:
Ta có phương trình hóa học:
H2SO4 + 2NaHCO3 → Na2SO4 + 2CO2 ↑ + 2H2O
Số mol của H2SO4:
nH2SO4 = 980 / 98 = 10 (mol)
Theo PTHH, ta có số mol của CO2
nCO2 = 2nH2SO4 = 2 x 10 = 20 (mol)
Thể tích của khí CO2 tạo thành ở điều kiện tiêu chuẩn là:
VCO2 = nCO2 x 22,4 = 20 x 22,4 = 448 (lít)