Metan là một chất khí quen thuộc và là nguồn nguyên liệu quan trọng trong đời sống và trong công nghiệp. Nó có ứng dụng rộng rãi trong cuộc sống hàng ngày cũng như trong ngành công nghiệp hóa chất. Vậy metan có cấu tạo phân tử như thế nào? Tính chất vật lý và hóa học của metan là gì? Chúng ta sẽ cùng tìm hiểu về metan trong bài viết hôm nay nhé!
Xem thêm:
- Tính chất vật lý và hóa học của etilen
- Tính chất vật lý và hóa học của axetilen
- Tính chất vật lý và hóa học của benzen
I. Tính chất vật lý và trạng thái tự nhiên của Metan (CH4)
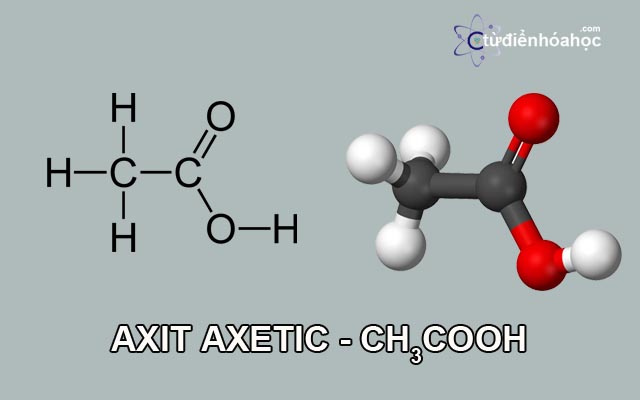
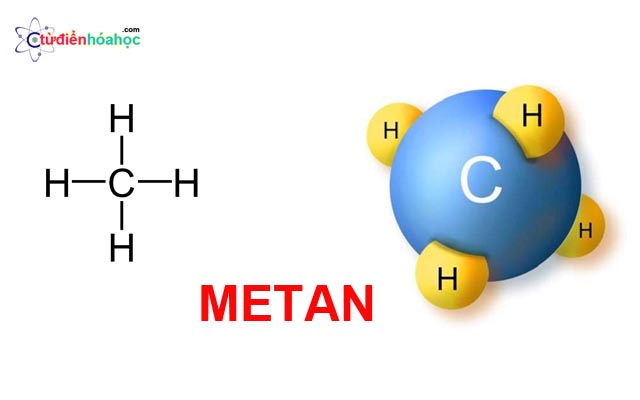
Metan có công thức phân tử là CH4 và phân tử khối bằng 16 đvC.
Trong tự nhiên, metan có nhiều trong:
- Trong các mỏ khí (khí thiên nhiên)
- Trong mỏ dầu (khí mỏ hay khí đồng hành)
- Trong các mỏ than (khí mỏ than)
- Trong bùn ao (khí bùn ao)
- Trong khí biogaz…
Metan là chất khí không màu, không mùi, không vị, nhẹ hơn không khí. Tỉ khối của metan với không khí là dCH4/kk = 16/29. Metan rất ít tan trong nước. Nó hóa lỏng ở −162 °C, hóa rắn ở −183 °C, và rất dễ bắt cháy.
II. Cấu tạo phân tử của Metan (CH4)
Metan là một hidrocacbon đơn giản nhất có công thức phân tử là CH4. Nó là một hidrocacbon nằm trong dãy đồng đẳng ankan. Trong phân tử CH4 có 4 liên kết đơn:
Tính chất vật lý và hóa học của metan
metan
III. Tính chất hóa học của Metan (CH4)
1. Metan (CH4) tác dụng với oxi (phản ứng cháy)
Metan tác dụng với O2 tạo thành khí cacbonic và hơi nước.
CH4 + 2O2 (t°) → CO2 + 2H2O
2. Metan (CH4) tác dụng với halogen
Metan tác dụng với các halogen như Cl2, Br2… Phản ứng giữa metan và halogen được gọi là phản ứng thế và diễn ra theo nhiều giai đoạn.
CH4 + Cl2 (ánh sáng) → CH3Cl + HCl
CH3Cl + Cl2 (ánh sáng) → CH2Cl2 + HCl
CH2Cl2 + Cl2 (ánh sáng) → CHCl3 + HCl
CHCl3 + Cl2 (ánh sáng) → CCl4 + HCl
3. Phản ứng phân hủy của Metan (CH4)
Ở nhiệt độ trên 1000 °C, CH4 bị phân hủy tạo thành C và H2.
CH4 (1000 °C) → C + 2H2
IV. Ứng dụng của metan
– Metan là nguyên liệu quan trong trong đời sống và sản xuất vì khi cháy nó tạo ra nhiệt lượng lớn.
– Là nguyên liệu để điều chế H2.
CH4 + H2O (t°, xt) → CO2 + H2
– Là nguyên liệu để điều chế bột than và nhiều chất khác như metanol, axit axetic, anhydrit axetic…

tinh-chat-vat-ly-va-hoa-hoc-cua-metan
V. Sản xuất metan
Metan có thể được sản xuất từ Al4C3, đường glucozo, CH3-COONa, khí thiên nhiên, CO, C và H…
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
Al4C3 + 12HCl → 4AlCl3 + 3CH4
C6H12O6 → 3CO2 + 3CH4
CH3-COONa + NaOH → Na2CO3 + CH4
CH3-CH2-CH3 (cracking) → CH4 + CH2=CH2
CO + 3H2 → H2O + CH4
C + 2H2 → CH4
VII. Giải bài tập về khí Metan (CH4)
Câu 1. Trong các khí sau: CH4, H2, Cl2, O2.
a) Những chất nào tác dụng với nhau từ đôi một?
b) Hai khí nào trộn với nhau tạo ra hỗn hợp nổ?
Bài làm:
a) Những cặp chất khí tác dụng với nhau từng đôi một là:
– CH4 và Cl2: CH4 + Cl2 → CH3Cl + HCl
– CH4 và O2: CH4 + 2O2 (t°) → CO2 + 2H2O
– H2 và Cl2: H2 + Cl2 → 2HCl ↑
– H2 và O2: 2H2 + O2 (t°) → 2H2O
b) Hai khí nào trộn với nhau tạo ra hỗn hợp nổ là CH4 và O2 hoặc H2 và O2.
Câu 2. Trong các phương trình hóa học sau, phương trình hóa học nào viết đúng? PTHH nào viết sai?
a) CH4 + Cl2 (ánh sáng) → CH2Cl2 + H2
b) CH4 + Cl2 (ánh sáng) → CH2 + 2HCl
c) 2CH4 + Cl2 (ánh sáng) → 2CH3Cl + H2
d) CH4 + Cl2 (ánh sáng) → CH3Cl + HCl
Bài làm:
PTHH viết đúng là d. Phương trình hóa học viết sai là a, b và c.
Câu 3. Đốt cháy hoàn toàn 11,2 lít khí metan. Hãy tính thể tích khí O2 cần dùng và thể tích khí CO2 tạo thành. Biết các thể tích khí đo ở đktc.
Bài làm:
Ta có:
Số mol của CH4: nCH4 = 11,2 / 22,4 = 0,5 mol
PTHH:
CH4 + 2O2 (t°) → CO2 + 2H2O
Theo PTHH, ta có:
- nO2 = 2nCH4 = 2 x 0,5 = 1 mol
- nCO2 = nCH4 = 0,5 mol
Thể tích của O2 cần dùng và thể tích CO2 tạo thành là:
- VO2 = 1 x 22,4 = 22,4 lít
- VCO2 = 0,5 x 22,4 = 11,2 lít
Câu 4. Có một hỗn hợp khí gồm CO2 và CH4. Hãy trình bày phương pháp hoá học để :
a) Thu được khí CH4.
b) Thu được khí CO2.
Bài làm:
a) Thu khí CH4
Dẫn hỗn hợp hai khí trên qua dung dịch nước vôi trong dư, khí CO2 bị giữ lại, ta thu được khí CH4.
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
b) Thu khí CO2
Lọc lấy kết tủa, rửa sạch rồi đem nung nóng thu được khí CO2.
CaCO3 → CaO + CO2