Etilen (C2H4) là nguyên liệu để điều chế polietilen – một chất dùng trong công nghiệp chất dẻo. Ngoài ra etilen còn nhiều ứng dụng quan trọng khác. Vậy etilen có cấu tạo phân tử như thế nào? Tính chất vật lý và hóa học của etilen là gì? Trong bài viết hôm nay, chúng ta sẽ cùng tìm hiểu cấu tạo, tính chất và ứng dụng của etilen các bạn nhé!
Xem thêm:
- Tính chất vật lý và hóa học của metan
- Tính chất vật lý và hóa học của axetilen
- Tính chất vật lý và hóa học của benzen
Cấu tạo phân tử, tính chất vật lý và hóa học của Etilen
I. Cấu tạo phân tử của etilen
Etilen có công thức phân tử là C2H4. Nguyên tử khối của C2H4 bằng 28 g/mol. Trong phân tử C2H4, mỗi nguyên tử C liên kết với 2 nguyên tử H. Hai nguyên tử C liên kết với nhau bằng một liên kết đôi.
Tronng liên kết đôi giữa C=C, có 1 liên kết kém bền. Liên kết này dễ bị đứt ra trong các phản ứng hóa học.
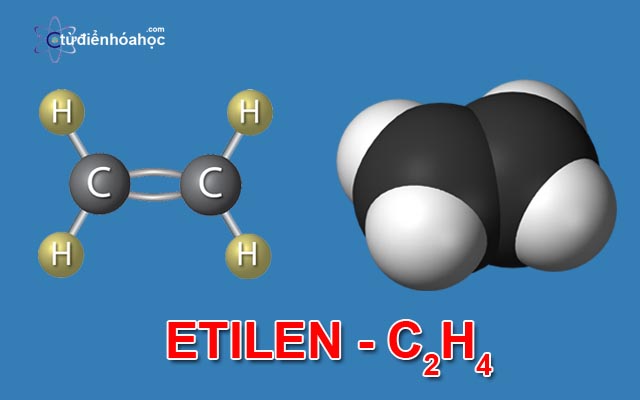
tinh-chat-vat-ly-va-hoa-hoc-cua-etilen
II. Tính chất vật lý của etilen
Etilen là một chất khí không màu, không mùi, nhẹ hơn không khí và ít tan trong nước nhưng tan nhiều trong ete và nhiều dung môi hữu cơ. Etilen nhẹ hơn không khí, tỉ khối dC2H4/kk = 28/29.
III. Tính chất hóa học của etilen
Etilen có những phản ứng hóa học đặc trưng như phản ứng cháy, phản ứng cộng và phản ứng trùng hợp.
1. Phản ứng cháy của etilen
C2H4 cháy trong oxi tạo ra khí cacbonic và hơi nước.
C2H4 + 3O2 (t°) → 2CO2 + 2H2O
2. Phản ứng cộng của etilen
Etilen có phản ứng cộng vào liên kết đôi với halogen, H2 và axit.
C2H4 + Br2 → C2H4Br2
C2H4 + H2 → C2H6
C2H4 + HBr → C2H5Br
3. Phản ứng trùng hợp của etilen
Ở điều kiện thích hợp (nhiệt độ, áp xuất, xúc tác), các phân tử C2H4 có thể kết hợp với nhau tạo thành phân tử có kích thước và phân tử khối lớn hơn, gọi là polietilen.
Phản ứng trên được gọi là phản ứng trùng hợp. Polietilen là chất rắn, không tan trong nước, không độc. Polietilen là nguyên liệu quan trọng trong ngành công nghiệp chất dẻo.
4. Những phản ứng hóa học khác của etilen
– Tác dụng với KMnO4:
3C2H4 + 2KMnO4 + 4H2O → 3C2H5(OH)2 + 2KOH + 2MnO2
– Phản ứng thế với Cl2, Br2 ở nhiệt độ cao:
CH2=CH2 + Cl2 → CH2=CHCl + HCl
IV. Ứng dụng của etilen
Etilen có nhiều ứng dụng quan trọng như làm nguyên liệu để sản xuất polietilen – PE, poli(vinyl clorua) – PVC… những chất quan trọng trong ngành sản xuất chất dẻo.
Những ứng dụng của etilen
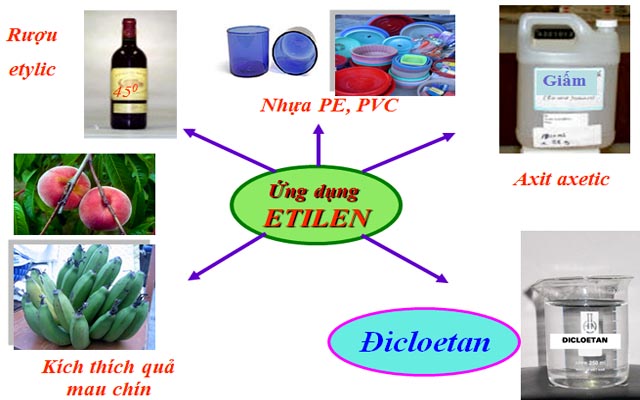
ung-dung-cua-etilen
Ngoài ra, etilen cũng dùng để sản xuất nhiều hóa chất quan trọng khác như rượu etylic, axit axetic, đicloetan… và kích thích quả mau chín.
Giải bài tập về etilen
Câu 1. Hãy tính số liên kết đơn, liên kết đôi giữa những nguyên tử cacbon trong phân tử các chất sau:
a) CH3 – CH3
b) CH2 = CH2
c) CH2 = CH – CH = CH2
Bài làm:
Số liên kết đơn và liên kết đôi giữa các nguyên tử cacbon là:
a) CH3 – CH3: có 1 liên kết đơn
b) CH2 = CH2: có 1 liên kết đôi
c) CH2 = CH – CH = CH2: có 1 liên kết đơn và 2 liên kết đôi
Câu 2. Điền từ thích hợp “có” hoặc “không” vào các cột sau:
| Có liên kết đôi | Làm mất màu dung dịch brom | Phản ứng trùng hợp | Tác dụng với oxi | |
| Metan | ||||
| Etilen |
Bài làm:
| Có liên kết đôi | Làm mất màu dung dịch brom | Phản ứng trùng hợp | Tác dụng với oxi | |
| Metan | Không | Không | Không | Có |
| Etilen | Có | Có | Có | Có |
Câu 3. Hãy nêu phương pháp hoá học loại bỏ khí etilen có lẫn trong khí metan để thu đuợc metan tinh khiết.
Bài làm:
Dẫn hỗn hợp khí qua dung dịch nước brom dư, khí etilen tác dụng với dung dịch brom và bị giữ lại. Thu lấy khí còn lại, ta được khí metan tinh khiết.
CH2=CH2 + Br2 → Br-CH2-CH2-Br
Câu 4. Để đốt cháy 4,48 lít khí etilen C2H4 cần phải dùng:
a) Bao nhiêu lít oxi?
b) Bao nhiêu lít không khí chứa 20% thể tích oxi?
Biết thể tích các khí đo ở đktc.
Bài làm:
C2H4 + 3O2 (t°) → 2CO2 + 2H2O
a) Ta có số mol của C2H4 là:
nC2H4 = 4,48/22,4 = 0,2 (mol)
Theo phương trình hóa học, ta có:
nO2 = 3nC2H4 = 3 x 0,2 = 0,6 (mol)
Thể tích khí oxi cần dùng là:
VO2 = 0,6 x 22,4 = 13,44 (lít)
b) Thể tích không khí chứa 20% thể tích O2 cần dùng là:
Vkk = 13,44 x 100/20 = 67,2 (lít)