Chúng ta từng nghe nói đến sự điện li của các chất. Vậy sự điện li là gì? Thế nào là chất điện li mạnh và chất điện li yếu? Quá trình điện li của một chất sẽ tạo ra gì? Chúng ta sẽ cùng giải đáp những thắc mắc này trong bài viết hôm nay các bạn nhé!
I. Sự điện li là gì?
1. Khái niệm chất điện li
– Các dung dịch axit, bazo và muối dẫn điện được là do trong dung dịch của chúng có rất nhiều tiểu phân mang điện tích. Các tiểu phân này chuyển động tự do trong dung dịch và được gọi là ion.
– Quá trình phân li các chất trong nước tạo ra ion là sự điện li.

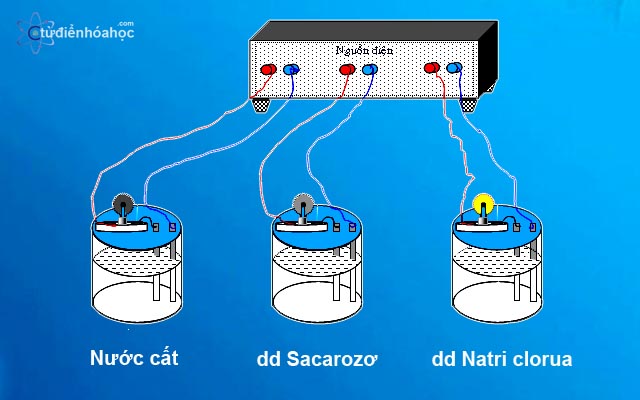
su-dien-li-cua-dung-dich
– Những chất khi tan trong nước phân li ra ion được gọi là những chất điện li. Axit, bazo và muối là những chất điện li.
2. Ví dụ về sự điện li
– Sự điện li được biểu diễn bằng phương trình điện li. Ví dụ:
NaCl → Na+ + Cl–
HNO3 → H+ + NO3–
NaOH → Na+ + OH–
II. Phân loại các chất điện li
1. Chất điện li mạnh
– Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li ra ion.
– Chất điện li mạnh là các axit mạnh như: HCl, HNO3, HClO4, H2SO4… hay các bazo mạnh như: NaOH, KOH, Ca(OH)2… và hầu hết các muối.
Na2SO4 → 2Na+ + SO42–
2. Chất điện li yếu
– Chất điện li yếu là chất khi tan trong nước chỉ có một số phân tử hòa tan phân li ra ion, phần còn lại vẫn còn tồi tại dưới dạng phân tử trong dung dịch.
su-dien-li-la-gi
– Chất điện li yếu là các axit yếu như: H2SO3, CH3COOH, H2S, HClO… hay các bazo yếu như: Mg(OH)2, Bi(OH)3…
CH3COOH ⇔ H+ + CH3COO–
III. Độ điện li là gì?
– Độ điện li α (anpha) của chất điện li là tỉ số giữa số phân tử phân li ra ion (n) và tổng số phân tử hòa tan (no).
– Công thức:
α = n/no (%)
Bài tập sự điện li, chất điện li và độ điện li
Câu 1. Các dd axit như HCl, bazo như naOH và muối như NaCl dẫn được điện, còn các dd như ancol etylic, saccarozo, glixerol không dẫn được điện là do nguyên nhân gì?
Giải:
– Các dung dịch HCl, NaOH, NaCl dẫn điện được vì trong dd có sự hiện diện của các ion mang điện tích chuyển động tự do.
– Các dd ancol etylic, saccarozơ, glixerol không dẫn điện được vì trong dd không có sự hiện diện của các ion.
Câu 2. Sự điện li, chất điện li là gì?
Những loại chất nào là chất điện li? Thế nào là chất điện li mạnh và chất điện li yếu? Lấy VD và viết phương trình điện li của chúng.
Giải:
– Sự điện li là quá trình phân li các chất trong nước tạo ra ion.
– Chất điện li lànhững chất khi tan trong nước phân li ra ion.
– Axit, bazo và muối là những chất điện li.
– Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li ra ion. VD: HCl, H2SO4, HNO3, HClO4…
HCl → H+ + Cl–
H2SO4 → 2H+ + SO42-
HNO3 → H+ + NO3–
HClO4 → H+ + ClO4–
– Chất điện li yếu là chất khi tan trong nước chỉ có một số phân tử hòa tan phân li ra ion, phần còn lại vẫn còn tồi tại dưới dạng phân tử trong dung dịch. VD: CH3COOH, H2S, H2SO3, HF…
CH3COOH ⇔ H+ + CH3COO–
H2S ⇔ 2H+ + S2-
H2SO3 ⇔ 2H+ + SO32-
HF ⇔ H+ + F–
Câu 3. Viết phương trình điện li của các chất sau:
a) Các chất điện li mạnh: Ba(NO3)20,10M ; HNO30,020M ; KOH 0,010M.
Tính nồng độ mol của từng ion trong các dung dịch trên.
b) Các chất điện li yếu: HClO, HNO2.
Giải:
a) Các chất điện li mạnh
Ba(NO3)2 → Ba2+ + 2NO3–
0,01M 0,10M 0,20M
HNO3 → H+ + NO3–
0,020M 0,020M 0,020M
KOH → K+ + OH–
0,010M 0,010M 0,010M
b) Các chất điện li yếu:
HClO ⇔ H+ + ClO–
HNO2 ⇔ H+ + NO2–
Câu 4. Chọn câu trả lời đúng:
DD chất điện li dẫn điện được là do:
A. Sự chuyển dịch của các electron.
B. Sự chuyển dịch của các cation.
C. Sự chuyển dịch của các phân tử hòa tan.
D. Sự chuyển dịch của cả cation và anion.
Đáp án đúng: D
Câu 5. Chất nào không dẫn điện được:
A. KCl rắn, khan.
B. CaCl2 nóng chảy.
C. NaOH nóng chảy.
D. HBr hòa tan trong nước.
Đáp án đúng: A