Lý thuyết và bài tập sự điện ly của nước, cách tính độ pH và chất chỉ thị axit – bazơ là gì? Đây là nội dung bài 3 ở trang 11, 12, 13, 14, SGK Hóa Học lớp 11. Các bạn cần nắm nội dung chính sau đây:
- Biết đánh giá độ axit và độ kiềm của các dung dịch theo nồng độ ion H+ và pH.
- Biết màu của một số chất chỉ thị trong dung dịch ở các khoảng pH khác nhau.
I – Nước là chất điện li rất yếu
1. Sự điện li của nước
Người ta dùng dụng cụ đo nhạy phát hiện nước cũng dẫn điện những cực kì yếu. Do đó, nước cũng là một chất điện li rất yếu. Trong số hơn nữa tỉ phân tử nước thì có 1 phân tử H2O phân li ra ion:
H2O ⇔ H+ + OH–
2. Tích số ion của nước
Từ phương trình điện li của nước, ta thấy 1 phân tử H2O phân li ra 1 ion H+ và 1 ion OH–, mà nước có môi trường trung tính. Do đó:
Môi trường trung tính là môi trường trong đó [H+]= [OH–]
Bằng thực nghiệm, người ta đã xác định được:
[H+] = [OH–] = 10-7 (mol/l) ở 25oC
Tích số ion của nước: KH2O(25oC) = [H+].[ OH–] = 10-7*10-7 = 10-14
Một cách gần đúng, có thể xem tích số ion của nước là hằng số trong dung dịch loãng của các chất khác nhau và ở nhiệt độ gần với 25oC.
3. Ý nghĩa tích số ion của nước
Tích số ion của nước được áp dụng rất nhiều trong việc tính toán nồng độ [H+] và [ OH–] trong các loại dung dịch. Dựa vào kết quả này, có thể biết được độ axit và kiềm của dung dịch đó. Tích số ion của nước được xác định ở nhiệt độ 25oC là 10-14, những nếu nhiệt độ không chênh lệch nhiều thì chúng ta vẫn tạm dùng hằng số này trong tính toán.
a) Môi trường axit
Môi trường axit là môi trường có [H+] > [OH–] hay [H+] > 10-7 M(mol/lít)
Ví dụ: Thêm axit HCl vào nước sao cho dung dịch axit có nồng độ 10-3 M.
Phương trình điện li của HCl: HCl ⇔ H+ + Cl–
[H+] = [HCl] = 10-3 M
Tích số ion không đổi trong môi trường dung dịch axit loãng. Do đó:
[OH–] = 10-14/[H+] = 10-14/10-3 = 10-11 M
=> [H+] > [OH–]
Từ đây ví dụ ta có thể suy luận như sau:
Dung dịch có môi trường axit khi [H+] > [OH–] và ngược lại [H+] > [OH–] thì dung dịch có môi trường axit.
b) Môi trường kiềm
Môi trường kiềm là môi trường có [H+] < [OH–] hay [H+] < 10-7 M(mol/lít)
Ví dụ: Thêm một ít sút (NaOH) vào nước sao cho dung dịch kiềm có nồng độ 10-5 M.
Phương trình điện li: NaOH ⇔ Na+ + OH–
[OH–] = [NaOH] = 10-5 M
Tích số ion không đổi trong môi trường dung dịch axit loãng. Do đó:
[H+] = 10-14/[OH–] = 10-14/10-5 = 10-9 M
=> [H+] < [OH–]
Từ đây ví dụ ta có thể suy luận như sau:
Dung dịch có môi trường kiềm khi [H+] < [OH–] và ngược lại [H+] < [OH–] thì dung dịch có môi trường kiềm.
Tóm lại, để kết luận dung dịch có tính axit, kiềm hay trung tính ta có thể dựa vào nồng độ [H+].
- Môi trường trung tính: [H+] = 10-7 M
- Môi trường axit: [H+] > 10-7 M
- Môi trường kiềm: [H+] < 10-7 M
II – Khái niệm về pH. Chất chỉ thị axit – bazơ
1. Khái niệm về pH
Nồng độ H+ trong dung dịch rất nhỏ, để biểu thị nồng độ bằng số mũ âm thì không tiện cho việc so sánh. Do đó, người ta quy đổi nồng độ H+ sáng giá trị pH. Quy ước về chỉ số pH như sau:
- [H+] = 10-pH M, nếu [H+] = 10-a thì pH = a hay pH = -lg [H+]
Ví dụ:
[H+] = 10-2 M => pH = 2, môi trường axit
[H+] = 10-7 M => pH = 7, môi trường trung tính
[H+] = 10-10 M => pH = 10, môi trường kiềm
Thang đo pH có giá trị từ 1 đến 14
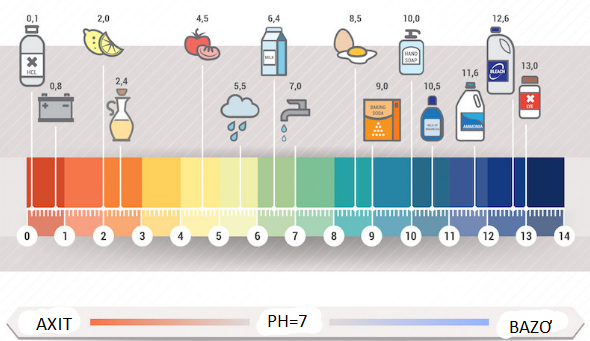 Độ pH có ý nghĩa rất lớn trong đời sống và khoa học.
Độ pH có ý nghĩa rất lớn trong đời sống và khoa học.
2. Chất chỉ thị axit – bazơ
Chất chỉ thị axit – bazơ là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch.
Quỳ tím và phenolphtalein là hai chất chỉ thị axit – bazơ thường dùng trong đời sống và bài tập hóa học ở SKG. Sau đây là màu hiển thị của hai chất chỉ thị axit – bazơ này.
 Màu của quỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau
Màu của quỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau
Màu sắc của quỳ và phenolphtalein chỉ có thể định tính một cách tương đối chứ không thể định lượng độ pH. Do đó, người Đức đã cho ra một chất chỉ thị vạn năng. Ngoài ra, máy đo pH với đầu dò cực nhạy sẽ giúp chúng ta xác định độ pH chính xác hơn.
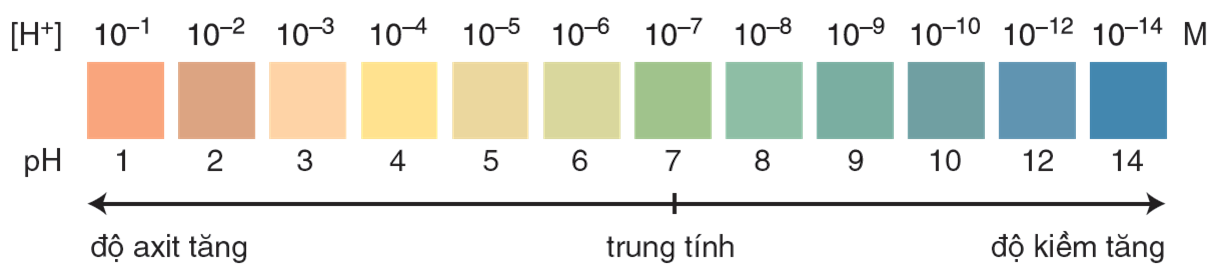 Màu hiển thị của chất chỉ thị vạn năng ở các giá trị pH từ 1 đến 14
Màu hiển thị của chất chỉ thị vạn năng ở các giá trị pH từ 1 đến 14
BÀI TẬP VỀ SỰ ĐIỆN LI CỦA NƯỚC. pH. CHẤT CHỈ THỊ AXIT – BAZƠ
Bài 1. Tích số ion của nước là gì và bằng bao nhiêu ở 25oC?
Giải:
Tích số ion của nước là tích số [H+].[OH–]. Có giá trị là KH2O(25oC) = 10-14 ở25oC
Bài 2. Phát biểu các định nghĩa môi trường axit, trung tính và kiềm theo nồng độ [H+] và pH.
Giải:
Môi trường axit là môi trường dung dịch có [H+] > 10-7 M hay pH < 7
Môi trường trung tính là môi trường dung dịch có [H+] = 10-7 M hay pH = 7
Môi trường kiềm là môi trường dung dịch có [H+] < 10-7 M hay pH > 7
Bài 3. Chất chỉ thị axit – bazơ là gì? Hãy cho biết màu của quỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau.
Giải:
Chất chỉ thị axit – bazơ là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch.
Đối với quỳ:
- pH ≤ 6, màu đỏ
- pH = 7, màu tím
- pH ≥ 8, màu xanh
Đối với phenolphtalein:
- pH < 8,3, không màu
- pH ≥ 8,3, màu hồng
Bài 4. Một dung dịch có [OH–] = 1,5.10-5 M. Môi trường của dung dịch này là
A. axit
B. trung tính
C. kiềm
D. không xác định được
Giải:
Ta có: [OH–] = 1,5.10-5 M => [H+] = 10-14/[OH–] = 10-14/1,5.10-5 < 10-7 M
Do đó, chọn đáp án C
Bài 5. Tính nồng độ [H+], [OH–] và pH của dung dịch HCl 0,1 M và dung dịch NaOH 0,01 M.
Giải:
Đối với dung dịch HCl 0,1 M, ta có:
- Phương trình điện li: HCl ⇔ H+ + Cl–
- [H+] = [HCl] = 0,1 M = 10-1 M => [OH–] = 10-14/[H+] = 10-13 M
- pH = -lg[H+] = 1
Đối với dung dịch NaOH 0,01 M, ta có:
- Phương trình điện li: NaOH ⇔ Na+ + OH–
- [OH–] = [NaOH] = 0,01 M = 10-2 M => [H+] = 10-14/[OH–] = 10-12 M
- pH = -lg[H+] = 12
Bài 6. Trong dung dịch HCl 0,01 M, tích số ion của nước là
A. [H+].[ OH–] > 1.10-14
B. [H+].[ OH–] = 1.10-14
C. [H+].[ OH–] < 1.10-14
D. Không xác định được.
Giải:
Dung dịch HCl 0,01 M được xem là dung dịch loãng. Do đó, tích số ion của nước là hằng số KH2O(25oC) = [H+].[ OH–]= 10-14
=> Chọn đáp án B
Tóm lại, qua bài học hôm nay các bạn cần nắm vững lý thuyết và làm bài tập về:
- Tích số ion của nước là hằng số không đổi đối với dung dịch loãng
- Cách tính độ pH của dung dịch
- Cách đo độ pH bằng thang đo của chất chỉ thị độ pH
- Kết luận được tính axit, bazơ, trung tính của một dung dịch bất kì dựa trên [H+], [ OH–], độ pH và chất chỉ thị.