Khái niệm đơn chất, hợp chất là gì? Phân tử và nguyên tử khác nhau như thế nào? Và chất có những trạng thái ra sao? Mời các bạn và các em cùng tìm hiểu trong bài viết này nhé!
Đơn chất – Hợp chất – Phân tử – Trạng thái của chất
1. ĐƠN CHẤT
1.1. Định nghĩa đơn chất là gì?
Đơn chất là những chất được tạo nên từ một nguyên tố hóa học. Ví dụ:
+ Đơn chất đồng, sắt, nhôm, canxi… được tạo nên từ các nguyên tố Cu, Fe, Al, Ca.
+ Đơn chất oxi, heli, nitơ, hiđro… được tạo nên từ các nguyên tố O, He, Ni, H.
don-chat
1.2. Phân loại đơn chất
Đơn chất kim loại: có ánh kim, dẫn điện, dẫn nhiệt
+ Đồng (Cu), nhôm (Al), sắt (Fe), natri (Na), kẽm (Zn)… là những đơn chất kim loại.
Đơn chất phi kim: không có ánh kim, không dẫn điện, dẫn nhiệt (trừ than chì dẫn điện).
+ Hidro (H), oxi (O), nitơ (N), lưu huỳnh (S)… là những đơn chất phi kim
1.3. Đặc điểm cấu tạo của đơn chất
Đơn chất kim loại: các nguyên tử sắp xếp khít với nhau theo một trật tự nhất định.
Đơn chất phi kim: các nguyên tử thường liên kết với nhau theo một số nhất định (thường là 2 nguyên tử liên kết với nhau)
Đặc điểm cấu tạo đơn chất kim loại
2. HỢP CHẤT
2.1. Định nghĩa hợp chất là gì?
Hợp chất là những chất được tạo nên từ hai hay nhiều nguyên tố hóa học.
2.2. Phân loại hợp chất
Hợp chất vô cơ:
+ Nước được tạo nên từ 2 nguyên tố: H và O.
+ Đá vôi được tạo nên từ 3 nguyên tố: Ca, C và O.
Hợp chất hữu cơ:
+ Khí metan được tạo nên từ 2 nguyên tố: C và H
+ Dấm ăn được tạo nên từ 3 nguyên tố: C, H và O
Đặc điểm cấu tạo
Trong một hợp chất, nguyên tử của các nguyên tố liên kết với nhau theo một tỉ lệ và một thứ tự nhất định.
3. PHÂN TỬ
3.1. Định nghĩa phân tử là gì?
Phân tử là hạt đại diện cho chất, gồm một số nguyên tử liên kết với nhau và thể hiện đầy đủ tính chất hóa học của chất.
Với đơn chất kim loại, nguyên tử liên kết với nhau và có vai trò như phân tử.
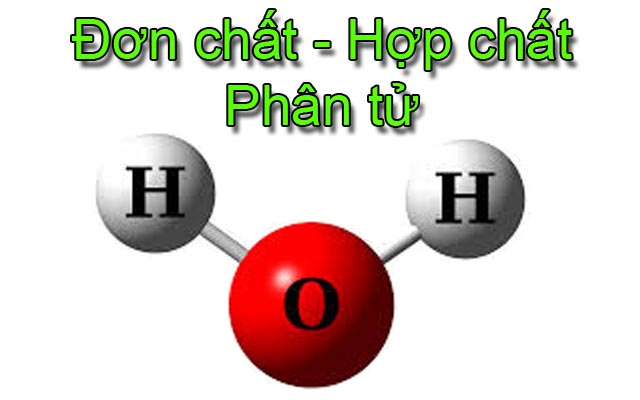
Phân tử nước
don-chat-hop-chat-phan-tu-trang-thai-cua-chat
Ví dụ:
+ Nước: gồm 2 nguyên tử H liên kết 1 nguyên tử O.
+ Muối ăn: gồm 1 nguyên tử Na liên kết với 1 nguyên tử Cl.
3.2. Phân tử khối
Phân tử khối là khối lượng phân tử tính bằng đơn vị cacbon.
Phân tử khối bằng tổng nguyên tử khối của các nguyên tử hợp thành nó.
Ví dụ:
+ Phân tử khối của khí nito = 2 x 14 = 28 đvC.
+ Phân tử khối của khí cacbonic = 12 + 2 x 16 = 44 đvC.
4. TRẠNG THÁI CỦA CHẤT
Chất tồn tại ở 3 trạng thái là: rắn, lỏng, khí. Một chất có thể tồn tại ở cả 3 trạng thái tùy vào điều kiện nhiệt độ và áp xuất.
Trạng thái rắn: các hạt sắp xếp khít nhau và dao động tại chỗ
Trạng thái lỏng: các hạt ở gần nhau và trượt lên nhau
Trạng thái khí: các hạt rất xa nhau, chuyển động nhanh và hỗn độn.
Giải các bài tập liên quan đến chất và hợp chất
Câu 1. Điền vào chỗ trống:
– đơn chất – hợp chất – nguyên tố hóa học – hợp chất
– đơn chất kim loại – đơn chất phi kim – phi kim
– hợp chất vô cơ – hợp chất hữu cơ
Câu 2.
a) Kim loại đồng và sắt được tạo nên lần lượt từ các nguyên tố: Cu và Fe. Trong đơn chất kim loại, các nguyên tử sắp xếp khít với nhau theo một trật tự nhất định.
b) Khí nito , khí clo được tạo nên lần lượt từ các nguyên tố: N và Cl. Những đơn chất phi kim như khí nito, clo, oxi hay hidro, nguyên tử thường liên kết với nhau theo một số nhất định (thường là 2 nguyên tử liên kết với nhau).
Câu 3. Chỉ ra và giải thích chất nào là đơn chất, chất nào là hợp chất:
a) Khí amoniac tạo nên từ N và H → Hợp chất vì tạo nên từ 2 nguyên tố hóa học (NTHH).
b) Phopho đỏ tạo nên từ P → Đơn chất vì tạo nên từ 1 NTHH.
c) Axit clohidric tạo nên từ H và Cl → Hợp chất vì tạo nên từ 2 NTHH.
d) Canxicabonat tạo nên từ Ca, C và O → Hợp chất vì tạo nên từ 3 NTHH.
e) Glucozo tạo nên từ C, H, O → Hợp chất vì tạo nên từ 3 NTHH.
f) Kim loại Magie tạo nên từ Mg → Đơn chất vì tạo nên từ 1 NTHH.
Câu 4.
a) Phân tử là hạt đại diện cho chất, gồm một số nguyên tử liên kết với nhau và thể hiện đầy đủ tính chất hóa học của chất.
b) Phân tử của hợp chất gồm những nguyên tử khác loại liên kết với nhau, còn phân tử của đơn chất gồm những nguyên tử cùng loại liên kết với nhau.
Ví dụ:
+ Phân tử đơn chất: Khí hidro gồm 2 nguyên tử H liên kết với nhau.
+ Phân tử hợp chất: Axit sunfuric gồm 2 nguyên tử H, 1 nguyên tử S và 4 nguyên tử O liên kết với nhau.
Câu 5. Điền từ và con số thích hợp vào chỗ trống:
Đáp án: nguyên tử – nguyên tố – 1 : 2 – gấp khúc – đường thẳng
Câu 6. Tính phân tử khối:
a) Cacbon dioxit (1 C và 2 O) → Phân tử khối = 12 + 2 x 16 = 44 đvC.
b) Khí metan (1 C và 4 H) → Phân tử khối = 12 + 4 x 1 = 16 đvC.
c) Axit nitric (1 H, 1 N và 3 O) → Phân tử khối = 1 + 14 + 3 x 16 = 63 đvC.
d) Thuốc tím (kali pemanganat) (1 K, 1 Mn và 4 O) → Phân tử khối = 39 + 55 + 4 x 16 = 158 đvC.
Câu 7. So sánh phân tử oxi nặng hay nhẹ bao nhiêu lần so với các phân tử sau đây:
Ta có:
Khối lượng phân tử của oxi (2 O) = 2 x 16 = 32 đvC.
Khối lượng phân tử của nước (2 H và 1 O) = 2 x 1 + 16 = 18 đvC.
Khối lượng phân tử của muối ăn (1 Na và 1 Cl) = 23 + 35,5 = 58,5 đvC.
Khối lượng phân tử khí metan (1 C và 4 H) = 12 + 4 x 1 = 16 đvC.
Lấy khối lượng phân tử của oxi chia cho khối lượng phân tử của các chất trên, ta được:
Khối lượng phân tử của oxi nặng hơn của nước: 32/18 = 1.77 lần
Khối lượng phân tử của oxi nhẹ hơn của muối ăn: 32/58,5 = 0.55 lần
Khối lượng phân tử oxi nặng hơn của metan: 32/16 = 2 lần.
Câu 8. Dựa vào sự phân bố phân tử khi chất ở trạng thái khác nhau, giải thích:
a) Nước lỏng tự chảy loang ra trên khay đựng
Trả lời: Vì nước lỏng là nước đang ở thể lỏng. Khi ở thể lỏng, các phân tử nước trượt lên nhau dễ dàng. Chính vì thể mà nước lỏng tự chảy được và loang ra trên khay đựng.
b) 1 ml nước lỏng khi chuyển sang thể hơi lại chiếm 1300 ml (ở nhiệt độ thường).
Trả lời: Khi ở lỏng, các phân tử nước nằm ở gần nhau. Trong khi đó, khi ở thể hơi (khí), các phân tử hơi nước nằm cách rất xa nhau tạo thành một thể tích lớn hơn so với khi ở thể lỏng.
Chúc các bạn học thật tốt nhé!