Có thể nói, cacbon là một nguyên tố khá quen thuộc và gần gủi với chúng ta. Vậy, bạn đã biết gì về những điểm đặc biệt của nguyên tố này? Những phản ứng hóa học của cacbon và một số hợp chất của nó có gì đặc trưng? Chúng ta cùng tìm hiểu trong bài viết hôm nay nhé!
Phản ứng hóa học của Cacbon và hợp chất của nó
1. Đôi nét về nguyên tố cacbon
Không chỉ là một nguyên tố quen thuộc, cacbon là một nguyên tố đặc biệt mà khiến chúng ta phải nhớ mỗi khi đến nó:
– Tên gọi cacbon bắt nguồn từ tiếng Latinh “carbo”: có nghĩa là than. Đây cũng là nguồn gốc tên gọi Kỷ Than đá (carboniferous) trong niên đại địa chất.
– Nguyên tố cacbon được phát hiện từ thời tiền sử, là nguyên tố phổ biến thứ 4 trong vũ trụ về khối lượng (sau hidro, heli và oxi).
– Cacbon là nền tảng của hóa học hữu cơ và tồn tại trong mọi sự sống hữu cơ.
– Đồng vị 14C được ứng dụng trong ngành khảo cổ học và nghiên cứu địa chất. Nó được dùng để xác định độ tuổi tuyệt đối cho các mẫu vật.
Nguyên tố cacbon

phan-ung-hoa-hoc-cua-cacbon-va-hop-chat-cua-no
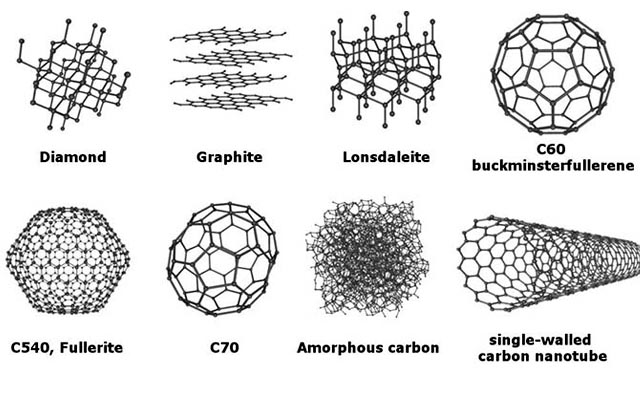
2. Các dạng thù hình của cacbon
Bạn có biết, cacbon có đến 8 dạng thù hình. Đó là:
cac-dang-thu-hinh-cua-cacbon
Các dạng thù hình của cacbon
- Kim cương
- Graphit
- Lonsdaleit
- C60 (Buckyball)
- C540
- C70
- Cacbon vô định hình
- Single – walled cacbon nanotube (Buckytube)
3. Phản ứng hóa học của cacbon và một số hợp chất của nó
Dưới đây là một số phản ứng hóa học đặc trưng của cacbon và một số hợp chất của nó:
C + 2H2 → CH4 (đk: 600 °C, p, xúc tác Pt)
2C + H2 → C2H2 (đk: 1500 – 2000 °C)
C + O2 → CO2 (đk: 600 – 700 °C)
2C + O2 → 2CO (đk: >1000 °C)
C + 2F2 → CF4 (đk: > 900 °C)
C + 2S → CS2 (đk: 700 – 800 °C)
2C + N2 ⇔ C2N2 (đk: phóng điện)
C + Si → SiC (đk: 1200 – 1300 °C)
2C + Ca → CaC2 (đk: 550 °C)
C (kim cương) → C (than chì) (đk: > 1200 °C)
C + 2PbO → 2Pb + CO2 (đk: 600 °C)
C + H2O (hơi) ⇔ CO + H2 (đk: 800 – 100 °C)
C + 2H2SO4 (đặc, nóng) → CO2 + 2SO2 + 2H2O
C + 4HNO3 (đặc, nóng) → CO2 + 4NO2 + 2H2O
3C + 8H2SO4 (đặc) + 2K2Cr2O7 (đặc) → 2Cr2(SO4)3 + 2K2SO4 + 3CO2 + 8H2O
2C + Na2SO4 → Na2S + 2CO2 (đk: 600 °C)
2C + Na2CO3 → 2Na + 3CO (đk: 900 – 1000 °C)
CO + 3H2 → CH4 + H2O (đk: 150 – 200 °C, xúc tác Ni)
CO + 2H2 → CH3OH (đk: 250 – 300 °C, p, xúc tác MnO2/Cr2O3)
2CO + O2 → 2CO2 (đk: t° thường, xúc tác MnO2/CuO)
2CO + O2 → 2CO2 (đk: đốt trong không khí)
CO + Cl2 → CCl2O (đk: 125 – 150 °C, xúc tác C/Pt)
CO + NH3 → HCN + H2O (đk: 500 – 800 °C, xúc tác Al2O3/ThO2)
CO + H2O (hơi) ⇔ CO2 + H2 (đk: >230 °C, xúc tác Fe2O3)
CO + H2O (hơi) + CaO → CaCO3 + H2 (đk: 400 – 500 °C)
CO + NaOH → HCOONa (đk: 120 – 130 °C, p)
CO + PdCl2 + H2O → Pd + CO2 + 2HCl
3CO + 2KMnO4 + KOH + H2O → 2MnO2 + 3KHCO3 (đk: xúc tác Ag)
3CO + K2Cr2O7 + KOH + 4H2O → 2Cr(OH)3 + 3KHCO3 (đk: xúc tác HgO)
5CO + I2O5 → 5CO2 + I2
CO + Na2O2 → Na2CO3 (đk: t° thường)
CO2 + 4H2 → CH4 + 2H2O (đk: 200 °C, xúc tác Cu2O)
CO2 + C → 2CO (đk: > 1000 °C)
2CO2 → 2CO + O2 (đk: > 2000 °C)
CO2 + H2O ⇔ H2CO3
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3
CO2 + Ba(OH)2 → BaCO3 + H2O
2CO2 + Ba(OH)2 → Ba(HCO3)2
CO2 + H2O + BaCO3 → Ba(HCO3)2
CO2 + 2Mg → 2MgO + C (đk: 500 °C)
CO2 + 5Ca → 4CaO + CaC2
2CO2 + 2Na2O2 → 2Na2CO3 + O2
H2CO3 + NaOH → NaHCO3 + H2O
H2CO3 + 2NaOH → Na2CO3 + 2H2O
H2CO3 + Na2CO3 → 2NaHCO3
H2CO3 + Ca(OH)2 → CaCO3 + 2H2O
H2CO3 + CaCO3 → Ca(HCO3)2
CO2 + NH4OH (dung dịch NH3) → NH4HCO3
2HCN + 5HClO → 2CO2 + N2 + 5HCl + H2O
HCN + Cl2 + H2O → HOCN + 2HCl (đk: xúc tác Al2O3)
Lời kết
Cacbon quả là một nguyên tố thú vị và nhiều điều khám phá phải không các bạn. Hãy nhanh tay note ngay những phản ứng hóa học của cacbon và một số hợp chất của nó bạn nhé! Chúc các bạn luôn học tốt và góp nhặt được những kiến thức bổ ích cho mình!