Dãy hoạt động hóa học của kim loại thể hiện mức độ hoạt động hóa học khác nhau của các kim loại. Dựa vào dãy hoạt động này, chúng ta có thể dự đoán được một số tính chất hóa học của kim loại khi phản ứng với các chất khác. Vậy dãy hoạt động hóa học được xây dựng như thế nào? Ý nghĩa của nó ra sao? Mời các bạn chúng ta cùng tìm câu trả lời ngay sau đây nhé!

day-hoat-dong-hoa-hoc-cua-kim-loai
I. Dãy hoạt động hóa học của kim loại
1. Cách xây dựng dãy hoạt động hóa học của kim loại
a) Một số thí nghiệm
– Fe đẩy được Cu ra khỏi dd CuSO4 → Fe hoạt động hóa học mạnh hơn Cu.
– Cu đẩy được Ag ra khỏi dd AgNO3 → Cu hoạt động hóa học mạnh hơn Ag.
– Fe đẩy được H ra khỏi dd HCl, Cu thì không → Ta sắp Fe đứng trước H, Cu đứng sau H.
– Na phản ứng với nước ở t° thường, còn Fe thì không → Ta sắp Na đứng trước Fe.
Bằng nhiều thí nghiệm khác nhau, người ta sắp xếp các kim loại thành một dãy theo thứ tự giảm dần mức độ hoạt động hóa học.
b) Định nghĩa
Dãy hoạt động hóa học của kim loại là dãy các kim loại được sắp xếp theo chiều giảm dần mức độ hoạt động hóa học của chúng.
Dãy HĐHH của kim loại đầy đủ:
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au
2. Ý nghĩa của dãy hoạt động hóa học của kim loại
Dãy hoạt động hóa học của kim loại cho chúng ta biết:
a) Mức độ hoạt động hóa học của kim loại giảm dần từ trái qua phải.
Li là kim loại mạnh nhất, Au là kim loại kém hoạt động nhất.
b) Kim loại đứng trước Mg (Li, K, Ba, Ca, Na) phản ứng với nước ở đk thường tạo thành kiềm và khí H2.
2K + 2H2O → 2KOH + H2 ↑
Ca + 2H2O → Ca(OH)2 + H2 ↑
c) Kim loại đứng trước H phản ứng với một số dd axit (HCl, H2SO4 loãng …) giải phóng khí H2.
2Al + 6HCl → 2AlCl3 + 3H2 ↑
Fe + H2SO4 loãng → FeSO4 + H2 ↑
Cu + HCl → không phản ứng
d) Kim không tan trong nước (từ Mg trở về sau) đẩy kim loại đứng sau ra khỏi dung dịch muối.
Mg + FeCl2 → MgCl2 + Fe ↓
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag ↓
3. Cách ghi nhớ dãy hoạt động hóa học của kim loại
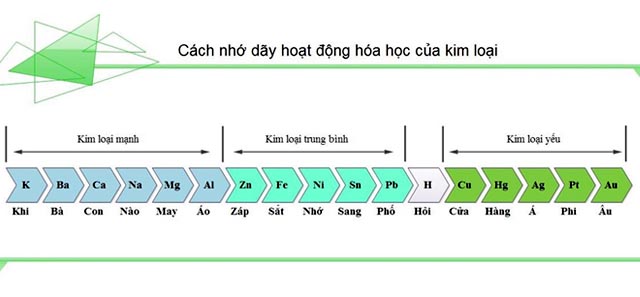
cach-nho-day-hoat-dong-hoa-hoc-cua-kim-loai
II. Giải bài tập về dãy hoạt động hóa học của kim loại
Câu 1. Dãy các kim loại nào sau đây được sắp xếp đúng theo chiều HĐHH tăng dần ?
a) K, Mg, Cu, Al, Zn, Fe
b) Fe, Cu, K, Mg, Al, Zn
c) Cu, Fe, Zn, Al, Mg, K
d) Zn, K, Mg, Cu, Al, Fe
e) Mg, K, Cu, Al, Fe
Bài làm:
Đáp án đúng: C
Câu 2. Dung dịch ZnSO4 có lẫn tạp chất là CuSO4. Dùng kim loại nào sau đây để làm sạch dd ZnSO4? Hãy giải thích và viết PTHH.
a) Fe
b) Zn
c) Cu
d) Mg
Bài làm:
Đáp án đúng: B
Cả 3 kim loại Fe, Zn và Mg đều đẩy được Cu ra khỏi dd CuSO4 nhưng chỉ có Zn đẩy được Cu và tạo thành một muối duy nhất là ZnSO4.
Zn + CuSO4 → ZnSO4 + Cu ↓
Câu 3. Viết các PTHH:
a) Điều chế CuSO4 từ Cu.
b) Điều chế MgCl2 từ mỗi chất sau: Mg, MgSO4, MgO, MgCO3.
(Các hoá chất cần thiết coi như có đủ).
Bài làm:
a) Điều chế CuSO4 từ Cu:
2Cu + O2 (t°) → 2CuO
CuO + H2SO4 → CuSO4 + H2O
Cu + 2H2SO4 đặc, nóng → CuSO4 + SO2 ↑ + 2H2O
b) Điều chế MgCl2
- Từ Mg:
Mg + 2НСl → MgCl2 + H2 ↑
Mg + FeCl2 → MgCl2 + Fe
- Từ MgSO4:
MgSO4 + BaCl2 → MgCl2 + BaSO4 ↓
- Từ MgO:
MgO + 2HCl → MgCl2 + H2O
- Từ MgCO3:
MgCO3 + 2HCl → MgCl2 + CO2 ↑ + H2O
Câu 4. Hãy cho biết hiện tượng xảy ra khi cho
a) Kẽm vào dd đồng clorua
b) Đồng vào dd bạc nitrat
c) Kẽm vào dd magie clorua
d) Nhôm vào dd đồng clorua
Viết các PTHH xảy ra, nếu có
Bài làm:
a) Kẽm vào dd đồng clorua: có chất rắn màu đỏ bám vào bề mặt Zn, đồng thời màu xanh của dd CuSO4 nhạt dần.
Zn+ CuCl2 → ZnCl2 + Cu
b) Đồng vào dd bạc nitrat: có chất răn màu xám bám vào bề mặt Cu, dung dịch từ không màu chuyển sang màu xanh và đậm dần.
Cu + 2AgNO3 → Cu( NO3)2 + 2Ag ↓
c) Kẽm vào dd magie clorua: không có hiện tượng do kẽm đứng sau Mg trong dãy HDDHH của kim loại nên không đẩy được Mg ra khỏi dd muối.
d) Nhôm vào dd đồng clorua: có chất rắn màu đỏ bám ngoài bề mặt Al, màu xanh của dd nhạt dần.
2Al + 3CuCl2 → 2AlCl3 + 3Cu
Câu 5. Cho 10,5 gam hỗn hợp 2 kim loại Cu, Zn vào dd H2SO4 loãng dư, người ta thu được 2,24 lít khí (ở đktc).
a) Viết PTHH
b) Tính khối lượng chất rắn còn lại sau phản ứng
Bài làm:
PTHH của phản ứng:
Zn + H2SO4 loãng → ZnSO4 + H2 ↑ (1)
Cu + H2SO4 loãng → không phản ứng
→ Chất rắn còn lại sau phản ứng là Cu.
b) Ta có:
nH2 = 2,24 / 22,4 = 0,1 (mol)
Theo PTHH (1), ta có: nZn = nH2 = 0,1 (mol)
⇒ mZn = 0,1 x 65 = 6,5 (g)
Khối lượng Cu còn lại sau phản ứng là:
mCu = mhh – mZn = 10,5 – 6,5 = 4 (g)